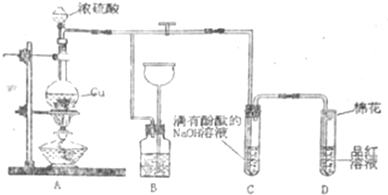
题目内容
17.“碳捕捉技术”是指通过一定的方法,将工业生产中产生的CO2分离出来进行储存和利用的工艺和技术.实际生产中,经常利用足量NaOH溶液来“捕捉”CO2,流程图如图(部分条件及物质未标出).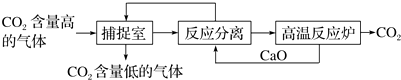
①“反应分离”发生反应的化学方程式为CaO+H2O=Ca(OH)2 Ca(OH)2+Na2CO3=CaCO3↓+2NaOH.
②若经过反应分离得到固体沉淀质量为1000g,则理论上经过高温反应炉出来的CO2质量为440g
③该生产过程中,CaO和Y溶液均为可以循环使用的物质,则Y溶液的溶质是NaOH(填写化学式).
分析 ①“反应分离”中发生的反应有:氧化钙溶于水生成氢氧化钙,然后氢氧化钙与碳酸钠反应生成白色沉淀碳酸钙和氢氧化钠,所以通过过滤可以将其分离开来;
②若经过反应分离得到固体沉淀质量为1000g为二氧化碳,结合碳元素守恒计算;
③“反应分离”发生反应可知氢氧化钠参与反应过程,最后又生成.
解答 解:①“反应分离”内CaO和水反应生成氢氧化钙,其反应方程式为:CaO+H2O=Ca(OH)2;然后氢氧化钙与碳酸钠发生复分解反应反应生成白色沉淀碳酸钙和氢氧化钠,其反应方程式为:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH,
故答案为:CaO+H2O=Ca(OH)2,Ca(OH)2+Na2CO3=CaCO3↓+2NaOH;
②若经过反应分离得到固体沉淀为碳酸钙质量为1000g,物质的量=$\frac{1000g}{100g/mol}$=10mol,碳元素守恒则理论上经过高温反应炉出来的CO2质量=10mol×44g/mol=440g,
故答案为:440;
③氢氧化钙与碳酸钠发生复分解反应反应生成白色沉淀碳酸钙和氢氧化钠,Na2CO3+Ca(OH)2=CaCO3↓+2NaOH,该生产过程中,CaO和Y溶液均为可以循环使用的物质,则Y溶液的溶质是氢氧化钠,
故答案为:NaOH.
点评 本题属于信息题的考查,考查了化学方程式的书写和流程图的分析,注重对学生解读解能力的考查,有利于培养学生的探究能力,题目难度中等.

练习册系列答案
相关题目
8.在常温下,将pH=9的NaOH溶液与pH=11的NaOH溶液等体积混合后,溶液的pH最接近于( )
| A. | 9.3 | B. | 9.7 | C. | 10.3 | D. | 10.7 |
5.瓦斯中氧气与甲烷的质量比为4﹕1时极易爆炸,此时氧气与甲烷的体积比为( )
| A. | 2﹕1 | B. | 1﹕2 | C. | 1﹕1 | D. | 1﹕4 |
9.下列关于有机物的说法正确的是( )
| A. | “西气东输”中的“气”主要成分是甲烷 | |
| B. | 乙烯的结构简式为CH2CH2 | |
| C. | 分子式为C6H6的物质一定是苯 | |
| D. | 乙烯使溴水褪色说明乙烯与溴发生了取代反应 |
6.X、Y、Z、W为四种短周期主族元素,且原子序数依次增大,其中X、Z同族,Y是短周期主族元素中原子半径最大的,X是农作物生长的三种必须营养元素之一,W的单质以前常用于自来水消毒.下列说法正确的是( )
| A. | Z的最高价氧化物的水化物能形成多种含Y元素的盐 | |
| B. | W的氧化物对应水化物的酸性一定强于Z | |
| C. | Y的单质应该保存在水中 | |
| D. | X的氢化物沸点比Z的氢化物沸点低 |
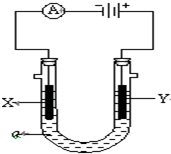 电解原理在化学工业中有广泛应用.图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
 .
.