题目内容
18.焦亚硫酸钠(化学式为Na2S2O5)是一种常用的食品抗氧化剂,Na2S2O5中硫元素的化合价为+4,工业上制备Na2S2O5的方法有多种,下面是其中的一种生产工艺流程图.
(1)晶体Ⅰ的成分是NaHCO3,操作Ⅱ包括过滤、洗涤、干燥,则洗涤剂最好是无水乙醇,干燥时需要在还原性气候或惰性气体氛围下,其原因Na2S2O5晶体在空气中被氧化生成Na2SO4
(2)写出有关反应方程式:CuS灼烧2CuS+3O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+2SO2,反应釜Ⅱ:2NaHCO3+2SO2=Na2S2O5+2CO2+H2O.
分析 一般的化合物中O元素化合价为-2价、Na元素化合价为+1,根据化合物中各元素化合价的代数和为0确定S元素化合价;
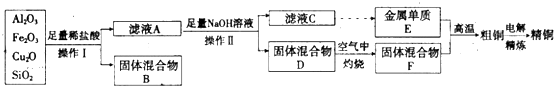
将氯化钠溶液中加入反应釜I中,通入氨气、二氧化碳,碳酸氢钠溶解度较小,所以发生反应NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl,析出NaHCO3晶体;将晶体I溶于水,然后向反应釜II中加入SO2,发生反应2NaHCO3+2SO2=Na2S2O5+2CO2+H2O,向反应釜II中加入等体积乙醇得到晶体II,则晶体II为Na2S2O5,过滤、洗涤得到纯品;
将CuS在空气中灼烧,发生反应2CuS+3O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+2SO2,得到的黑色固体CuO,将CuO溶于稀硫酸,生成硫酸铜,然后蒸发浓缩、冷却结晶、过滤、干燥得到硫酸铜,
据此分析解答.
解答 解:一般的化合物中O元素化合价为-2价、Na元素化合价为+1,根据化合物中各元素化合价的代数和为0得S元素化合价=$\frac{0-(-2)×5-(+1)×2}{2}$=+4,
故答案为:+4;
将氯化钠溶液中加入反应釜I中,通入氨气、二氧化碳,碳酸氢钠溶解度较小,所以发生反应NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl,析出NaHCO3晶体;将晶体I溶于水,然后向反应釜II中加入SO2,发生反应2NaHCO3+2SO2=Na2S2O5+2CO2+H2O,向反应釜II中加入等体积乙醇得到晶体II,则晶体II为Na2S2O5,过滤、洗涤得到纯品;
将CuS在空气中灼烧,发生反应2CuS+3O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+2SO2,得到的黑色固体CuO,将CuO溶于稀硫酸,生成硫酸铜,然后蒸发浓缩、冷却结晶、过滤、干燥得到硫酸铜,
(1)通过以上分析知,晶体Ⅰ的成分是NaHCO3,操作Ⅱ包括过滤、洗涤、干燥,则洗涤剂最好是乙醇,因为Na2S2O5溶于水即生成NaHSO3,干燥时需要在还原性气候或惰性气体氛围下,其原因Na2S2O5晶体在空气中被氧化生成Na2SO4,
故答案为:NaHCO3;无水乙醇;Na2S2O5晶体在空气中被氧化生成Na2SO4;
(2)CuS灼烧方程式为2CuS+3O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+2SO2,反应釜Ⅱ反应方程式为2NaHCO3+2SO2=Na2S2O5+2CO2+H2O,
故答案为:2CuS+3O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+2SO2;2NaHCO3+2SO2=Na2S2O5+2CO2+H2O.
点评 本题考查物质制备实验,为高频考点,侧重考查学生分析判断、基本实验操作等能力,明确物质性质、实验基本操作方法及原理是解本题关键,明确每一步发生的反应或基本操作方法,题目难度不大.

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案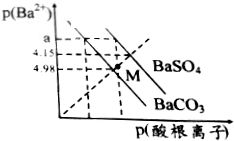 已知:p(Ba2+)=-lgc(Ba2+),p(酸根离子)=-lgc(酸根离子),酸根离子为SO42-或CO32-.某温度下BaSO4、BaCO3的沉淀溶解关系如图所示,下列叙述正确的是( )
已知:p(Ba2+)=-lgc(Ba2+),p(酸根离子)=-lgc(酸根离子),酸根离子为SO42-或CO32-.某温度下BaSO4、BaCO3的沉淀溶解关系如图所示,下列叙述正确的是( )| A. | p(Ba2+)=a时,溶液中所含的c(SO42-)>c(CO32-) | |
| B. | M点对应溶液中的Ba2+、CO32-能形成BaCO3沉淀 | |
| C. | 由图可知该温度下,KSP(BaSO4)<KSP(BaCO3) | |
| D. | BaSO4淀不能转化为BaCO3沉淀 |
| A. | 0.1mol•L-1的NaHS溶液中:c(OH-)=c(H+)+c(H2S) | |
| B. | 往氯化铵溶液中加水$\frac{c({H}^{+})•c(N{H}_{3}•{H}_{2}O)}{c(N{{H}_{4}}^{+})}$的值变大 | |
| C. | 0.1mol•L-1的NaOH溶液与0.2mol•L-1的HA溶液等体积混合,所得溶液呈现碱性:c(Na+)>c(HA)c(A-)>c(OH-)>c(H+) | |
| D. | pH相等的①NH4Cl②NH4Al(SO4)2③NH4HSO4溶液中,c(NH4+)大小顺序:①>②>③ |
| A. | 恒容通入一定量的SO2 | B. | 增大体系容积 | ||
| C. | 恒容移去部分SO3 | D. | 降低体系温度 |