题目内容
三草酸合铁酸钾晶体(K3[Fe(C2O4)3]?xH2O)是一种光敏材料,在110℃可完全失去结晶水.为测定该晶体中铁的含量和结晶水的含量,某实验小组做了如下实验:
(1)铁含量的测定
步骤一:称量5.00g三草酸合铁酸钾晶体,配制成250mL溶液.
步骤二:取所配溶液25.00mL于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部被氧化成二氧化碳,同时,MnO4-被还原成Mn2+.向反应后的溶液中加入一小匙锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍呈酸性.
步骤三:用0.010mol?L-1 KMnO4溶液滴定步骤二所得溶液至终点,消耗KMnO4溶液20.02mL,滴定中MnO4-被还原成Mn2+.
重复步骤二、步骤三操作,滴定消耗0.010mol?L-1 KMnO4溶液19.98mL.
请回答下列问题:
①配制三草酸合铁酸钾溶液的操作步骤依次是称量、 、转移、洗涤并转移、 、摇匀.
②步骤二中加入锌粉的目的是 .
③写出步骤三中发生反应的离子方程式: .
④实验测得该晶体中铁的质量分数为 .
(2)结晶水的测定
将坩埚洗净,烘干至恒重,记录质量;在坩埚中加入研细的三草酸合铁酸钾晶体,称量并记录质量;加热至110℃,恒温一段时间,置于空气中冷却,称量并记录质量;计算结晶水含量.请纠正实验过程中的两处错误: ; .
(1)铁含量的测定
步骤一:称量5.00g三草酸合铁酸钾晶体,配制成250mL溶液.
步骤二:取所配溶液25.00mL于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部被氧化成二氧化碳,同时,MnO4-被还原成Mn2+.向反应后的溶液中加入一小匙锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍呈酸性.
步骤三:用0.010mol?L-1 KMnO4溶液滴定步骤二所得溶液至终点,消耗KMnO4溶液20.02mL,滴定中MnO4-被还原成Mn2+.
重复步骤二、步骤三操作,滴定消耗0.010mol?L-1 KMnO4溶液19.98mL.
请回答下列问题:
①配制三草酸合铁酸钾溶液的操作步骤依次是称量、
②步骤二中加入锌粉的目的是
③写出步骤三中发生反应的离子方程式:
④实验测得该晶体中铁的质量分数为
(2)结晶水的测定
将坩埚洗净,烘干至恒重,记录质量;在坩埚中加入研细的三草酸合铁酸钾晶体,称量并记录质量;加热至110℃,恒温一段时间,置于空气中冷却,称量并记录质量;计算结晶水含量.请纠正实验过程中的两处错误:
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:(1)①根据配制一定物质的量浓度的溶液的操作步骤判断:在配制物质的量浓度的溶液时,要经过:计算→称量→溶解→移液、洗涤→振荡→定容→摇匀等步骤;
②锌粉能与Fe3+反应,加入锌粉的目的是将Fe3+恰好还原成Fe2+;
③根据物质的性质和书写离子方程式的有关要求书写离子方程式;
④根据离子方程式计算,n(Fe)=5n(MnO4-)=5×
×0.01 mol?L-1×10-3×10=1.0×10-2mol,m(Fe)=56 g?mol-1×1.0×10-2mol=0.56g.晶体中铁的质量分数=
×100%=11.2%,若在步骤二中滴入酸性高锰酸钾溶液不足,则会有部分草酸根离子未被氧化,在步骤三中则会造成消耗酸性高锰酸钾溶液的量偏大,从而计算出的铁的量增多,含量偏高.
(2)加热后的晶体要在干燥器中冷却,防止重新吸收空气中的水分.另外在加热时至少要称量两次质量差,到两次称量质量差不超过0.1 g.
②锌粉能与Fe3+反应,加入锌粉的目的是将Fe3+恰好还原成Fe2+;
③根据物质的性质和书写离子方程式的有关要求书写离子方程式;
④根据离子方程式计算,n(Fe)=5n(MnO4-)=5×
| 20.02ml+19.98ml |
| 2 |
| 0.56g |
| 5g |
(2)加热后的晶体要在干燥器中冷却,防止重新吸收空气中的水分.另外在加热时至少要称量两次质量差,到两次称量质量差不超过0.1 g.
解答:
解:(1)①在配制物质的量浓度的溶液时,要经过:计算→称量→溶解→移液、洗涤→振荡→定容→摇匀等步骤,
故答案为:溶解;定容;
②加入锌粉的目的是将Fe3+恰好还原成Fe2+,
故答案为:将Fe3+恰好还原成Fe2+,使Fe2+在步骤三中与KMnO4发生氧化还原反应;
③在步骤三中发生的离子反应为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,
故答案为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;
④根据步骤三中的离子反应可知:n(Fe)=5n(MnO4-)=5×
×0.01 mol?L-1×10-3×10=1.0×10-2mol,m(Fe)=56 g?mol-1×1.0×10-2mol=0.56g.晶体中铁的质量分数=
×100%=11.2%,
故答案为:11.2%;
(2)加热后的晶体要在干燥器中冷却,防止重新吸收空气中的水分.另外在加热时至少要称量两次质量差,到两次称量质量差不超过0.1 g,
故答案为:将固体置于干燥器中冷却,应将两次加热后固体质量的称量结果不超过0.1 g后,再计算结晶水含量.
故答案为:溶解;定容;
②加入锌粉的目的是将Fe3+恰好还原成Fe2+,
故答案为:将Fe3+恰好还原成Fe2+,使Fe2+在步骤三中与KMnO4发生氧化还原反应;
③在步骤三中发生的离子反应为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,
故答案为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;
④根据步骤三中的离子反应可知:n(Fe)=5n(MnO4-)=5×
| 20.02ml+19.98ml |
| 2 |
| 0.56g |
| 5g |
故答案为:11.2%;
(2)加热后的晶体要在干燥器中冷却,防止重新吸收空气中的水分.另外在加热时至少要称量两次质量差,到两次称量质量差不超过0.1 g,
故答案为:将固体置于干燥器中冷却,应将两次加热后固体质量的称量结果不超过0.1 g后,再计算结晶水含量.
点评:本题考查较为综合,涉及到溶液的配制、滴定和结晶等操作,注意基础实验知识的积累,把握实验步骤、原理和注意事项等问题,题目难度中等.

练习册系列答案
相关题目
pH=2的两种一元酸X和Y,体积均为100mL,稀释过程中pH与溶液体积的关系如图所示.分别滴加0.1mol/LNaOH至pH=7,消耗NaOH溶液的体积为VX、VY,下列说法正确的是( )
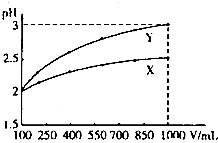

| A、X为弱酸,VX<VY |
| B、Y为强酸,VX>VY |
| C、X为强酸,VX>VY |
| D、Y为弱酸,VX>VY |



 碳及其化合物是一类种类繁多的大家族.
碳及其化合物是一类种类繁多的大家族.
 砷化镓(GaAs)属于第三代半导体,它能直接将电能转变为光能,砷化镓灯泡寿命是普通灯泡的100倍.已知砷化镓的晶胞结构如图.又知砷为33号元素 镓为31号元素.
砷化镓(GaAs)属于第三代半导体,它能直接将电能转变为光能,砷化镓灯泡寿命是普通灯泡的100倍.已知砷化镓的晶胞结构如图.又知砷为33号元素 镓为31号元素.