题目内容
 碳及其化合物是一类种类繁多的大家族.
碳及其化合物是一类种类繁多的大家族.(1)一定条件下,在某恒容密闭容器内发生下列反应:2NH3(g)+CO2(g)?NH2COONH4 (l)△H<0,能判断该反应达到化学平衡状态的依据是
A.容器中气体的密度不再变化
B.2v正(NH3)=2v逆(CO2)
C.容器中气体的压强不再变化
D.NH2COONH4的质量不再变化
(2)利用I2O5可消除CO污染,有关反应为:5CO(g)+I2O5(s)?5CO2(g)+I2(s)△H
已知:2CO(g)+O(g)?2CO2(g)△H1;
2I2(s)+5O2(g)?2I2O5(s)△H2;
则△H=
(3)向体积为VL的密闭容器中充入amol乙苯,发生反应:C6H5-CH2CH3(g)?C6H5-CH=CH2(g)+H2(g)△H
反应达到平衡状态时,平衡体系组成(物质的量分数)与温度的关系如图所示.在600℃时,平衡体系中苯乙烯的物质的量分数为25%,则:
①△H
②氢气的物质的量分数为
③此温度下该反应的平衡常数为
考点:化学平衡的计算,用盖斯定律进行有关反应热的计算,化学平衡的影响因素,化学平衡状态的判断
专题:基本概念与基本理论
分析:(1)可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质物质的量不变、物质的量浓度不变、百分含量不变以及由此引起的一系列物理量不变;
(2)2CO(g)+O2(g)?2CO2(g)△H1①、2I2(s)+5O2(g)?2I2O5(s)△H2②,将方程式①×
-
得5CO(g)+I2O5(s)?5CO2(g)+I2(s),△H进行相应的改变;
(3)①根据图象知,升高温度,苯乙烯、氢气的含量增大而乙苯含量减少,说明平衡向正反应方向移动,升高温度平衡向吸热反应方向移动,据此判断焓变;
②600℃时,利用三段式法计算各物质的物质的量,再利用苯乙烯的物质的量分数计算苯乙烯的物质的量,由氢气和苯乙烯的关系式计算氢气的物质的量,乙苯的转化率=
×100%;
③化学平衡常数K=
.
(2)2CO(g)+O2(g)?2CO2(g)△H1①、2I2(s)+5O2(g)?2I2O5(s)△H2②,将方程式①×
| 5 |
| 2 |
| ② |
| 2 |
(3)①根据图象知,升高温度,苯乙烯、氢气的含量增大而乙苯含量减少,说明平衡向正反应方向移动,升高温度平衡向吸热反应方向移动,据此判断焓变;
②600℃时,利用三段式法计算各物质的物质的量,再利用苯乙烯的物质的量分数计算苯乙烯的物质的量,由氢气和苯乙烯的关系式计算氢气的物质的量,乙苯的转化率=
| 参加反应的乙苯 |
| 总的乙苯 |
③化学平衡常数K=
| c(H2).c(苯乙烯) |
| c(乙苯) |
解答:
解:(1)A.该反应前后气体的计量数之和减小、气体的质量减少,容器体积不变,所以反应前后气体的密度减小,当容器中气体的密度不再变化时该反应达到平衡状态,故正确;
B.当v正(NH3):v逆(CO2)=2:1时该反应达到平衡状态,所以2v正(NH3)=2v逆(CO2)时该反应未达到平衡状态,故错误;
C.该反应前后气体体积减小,所以压强会改变,当容器中气体的压强不再变化时该反应达到平衡状态,故正确;
D.NH2COONH4的质量不再变化时该反应正逆反应速率相等,反应达到平衡状态,故正确;
故选ACD;
(2)2CO(g)+O2(g)?2CO2(g)△H1①、2I2(s)+5O2(g)?2I2O5(s)△H2②,将方程式①×
-
得5CO(g)+I2O5(s)?5CO2(g)+I2(s),△H=
,
故答案为:
;
(3)①根据图象知,升高温度,苯乙烯、氢气的含量增大而乙苯含量减少,说明平衡向正反应方向移动,升高温度平衡向吸热反应方向移动,所以该反应的正反应是吸热反应,△H>0,故答案为:>;
②600℃时,设生成苯乙烯的物质的量为x,
C6H5-CH2CH3(g)?C6H5-CH=CH2(g)+H2(g)
起始量 a mol 0 0
变化量 x mol x mol x mol
平衡量 (a-x)mol x mol x mol
由题可知:
×100%=25%,则x=
a,
即:a-x=2x,因为平衡体系中苯乙烯的物质的量分数为25%,则氢气的物质的量分数为25%,乙苯的物质的量分数为50%,
故答案为:25%;50%;
③根据②知,平衡时乙苯的物质的量=(a-x)mol=(a-
a)mol=
mol、n(C6H5-CH=CH2)=n(H2)=
amol,容器的体积为VL,则c(C6H5-CH2CH3)=
mol/L、c(C6H5-CH=CH2)=c(H2)=
mol/L,
化学平衡常数K=
=
=
,
故答案为:
.
B.当v正(NH3):v逆(CO2)=2:1时该反应达到平衡状态,所以2v正(NH3)=2v逆(CO2)时该反应未达到平衡状态,故错误;
C.该反应前后气体体积减小,所以压强会改变,当容器中气体的压强不再变化时该反应达到平衡状态,故正确;
D.NH2COONH4的质量不再变化时该反应正逆反应速率相等,反应达到平衡状态,故正确;
故选ACD;
(2)2CO(g)+O2(g)?2CO2(g)△H1①、2I2(s)+5O2(g)?2I2O5(s)△H2②,将方程式①×
| 5 |
| 2 |
| ② |
| 2 |
| 5△H1-△H2 |
| 2 |
故答案为:
| 5△H1-△H2 |
| 2 |
(3)①根据图象知,升高温度,苯乙烯、氢气的含量增大而乙苯含量减少,说明平衡向正反应方向移动,升高温度平衡向吸热反应方向移动,所以该反应的正反应是吸热反应,△H>0,故答案为:>;
②600℃时,设生成苯乙烯的物质的量为x,
C6H5-CH2CH3(g)?C6H5-CH=CH2(g)+H2(g)
起始量 a mol 0 0
变化量 x mol x mol x mol
平衡量 (a-x)mol x mol x mol
由题可知:
| xmol |
| (a-x+2x)mol |
| 1 |
| 3 |
即:a-x=2x,因为平衡体系中苯乙烯的物质的量分数为25%,则氢气的物质的量分数为25%,乙苯的物质的量分数为50%,
故答案为:25%;50%;
③根据②知,平衡时乙苯的物质的量=(a-x)mol=(a-
| 1 |
| 3 |
| 2a |
| 3 |
| 1 |
| 3 |
| 2a |
| 3V |
| a |
| 3V |
化学平衡常数K=
| c(H2).c(苯乙烯) |
| c(乙苯) |
| ||||
|
| a |
| 6V |
故答案为:
| a |
| 6V |
点评:本题考查较综合,涉及平衡常数的计算、转化率的计算、盖斯定律、平衡状态的判断等知识点,侧重考查计算、基本理论,会利用三段式法、平衡状态特征进行分析解答,题目难度不大.

练习册系列答案
相关题目
用NA表示阿伏加德罗常数的值,下列说法不正确的是( )
| A、在标准状况下,5.6L四氯化碳含有的分子数为0.25NA |
| B、1mol Cl2参加反应转移的电子数不一定为2NA |
| C、78g Na2O2固体中含有NA个阴离子 |
| D、足量的MnO2与500ml浓盐酸充分反应,产生了NA个Cl2分子,则盐酸的浓度一定大于8 mol/L |
下列物质属于非电解质的是( )
| A、CO2 |
| B、(NH4)2SO4 |
| C、Cl2 |
| D、HCl |
下列物质鉴别的方法正确的是( )
| A、用焰色反应鉴别氯化钠固体和氢氧化钠固体 |
| B、用丁达尔效应鉴别NaCl溶液和KCl溶液 |
| C、用AgNO3溶液鉴别NaCl溶液和Na2SO4溶液 |
| D、用萃取法鉴别溴水和碘水 |
下列各组离子一定可以大量共存的是( )
| A、在含大量Al3+的溶液中:NH4+、Na+、HCO3-、SO42- |
| B、能使甲基橙试液变红的溶液中:Na+、K+、MnO4-、NO3- |
| C、在水电离出的c(H+)=10-13mol?L-1 的溶液中:NH4+、[Al(OH)4]-、SO42-、NO3- |
| D、在pH=1的溶液中:K+、Fe2+、Cl-、NO3- |


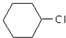 为原料合成重要的化工产品
为原料合成重要的化工产品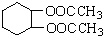 的路线流程图(无机试剂任选)合成路线流程图示例如图2.
的路线流程图(无机试剂任选)合成路线流程图示例如图2.