题目内容
pH=2的两种一元酸X和Y,体积均为100mL,稀释过程中pH与溶液体积的关系如图所示.分别滴加0.1mol/LNaOH至pH=7,消耗NaOH溶液的体积为VX、VY,下列说法正确的是( )
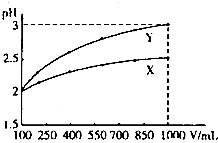

| A、X为弱酸,VX<VY |
| B、Y为强酸,VX>VY |
| C、X为强酸,VX>VY |
| D、Y为弱酸,VX>VY |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:根据稀释相同倍数酸x、y的pH变化,判断强酸、弱酸,pH相等的强酸和弱酸与碱反应,反应中弱酸还继续电离,弱酸消耗碱的量大.
解答:
解:从图象看,稀释10倍,Y的pH值变化1,X的pH值变化小于1,说明Y为强酸,X为弱酸.
pH相等的强酸和弱酸与碱反应,反应中弱酸还继续电离,故弱酸消耗碱的量大,即Vx>Vy,
故选B.
pH相等的强酸和弱酸与碱反应,反应中弱酸还继续电离,故弱酸消耗碱的量大,即Vx>Vy,
故选B.
点评:本题考查弱酸的电离及酸碱的反应,难度中等,根据酸稀释pH的变化判断强酸、弱酸是解题的关键.

练习册系列答案
相关题目
下列离子方程式书写正确的是( )
| A、氯化亚铁溶液中通入氯气:Fe2++Cl2═Fe3++2C1- |
| B、金属钠投入水中Na+H2O═Na++OH-+H2↑ |
| C、铝粉投入到NaOH溶液中:2Al+2OH-═2AlO2-+H2↑ |
| D、氯化铁溶液中加氨水3NH3?H2O+Fe3+=3NH4++Fe(OH)3↓ |
化学与能源开发、环境保护、资源利用等密切相关.下列说法正确的是( )
| A、无论是风力发电还是潮汐发电,都是将化学能转化为电能 |
| B、光缆在信息产业中有广泛应用,制造光缆的主要材料是单质硅 |
| C、推广燃煤脱硫技术,可以防治SO2污染 |
| D、凡含有食品添加剂的食物对人体健康均有害,不宜食用 |
将饱和FeCl3溶液分别滴入下列溶液或水中,能形成胶体的是( )
| A、冷水 |
| B、煮沸的蒸馏水 |
| C、NaOH浓溶液 |
| D、NaCl浓溶液 |
在密闭容器中发生可逆反应aA(g)+bB(g)?pC(g)△H<0,平衡时测得A的浓度为0.5mol/L保持温度不变,将容器的容积缩小到原来的一半,再达平衡时测得A的浓度为1.2mol/L下列有关判断正确的是( )
| A、C的体积分数下降 |
| B、a+b>p |
| C、正反应速率和逆反应速率均减小,平衡向逆反应方向移动 |
| D、正反应速率和逆反应速率均加大,平衡向正反应方向移动 |
下列物质属于非电解质的是( )
| A、CO2 |
| B、(NH4)2SO4 |
| C、Cl2 |
| D、HCl |
下列各离子浓度的大小比较,正确的是( )
| A、同浓度下列溶液中:①(NH4)2SO4 ②NH4HCO3 ③NH4Cl④NH3?H2O,C(NH4+)由大到小的顺序是:①>③>②>④ |
| B、常温时,将等体积的盐酸和氨水混合后,pH=7,则C(NH4+)>C (Cl-) |
| C、0.2 mol/LNa2CO3溶液中:C (OH-)=C (HCO3-)+C (H+)+C (H2CO3) |
| D、同浓度的下列溶液中,①NaCl ②Na2CO3 ③CH3COONa④NaOH,pH值由大到小的顺序是:④>③>②>① |
