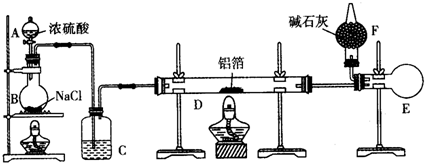
题目内容
2.浙江大学成功研制出能在数分钟之内将电量充满的锂电池,其成本只有传统锂电池的一半.若电解液为LiAlCl4-SOCl2,电池的总反应为:4Li+2SOCl2$\frac{\underline{\;充电\;}}{放电}$4LiCl+S+SO2.下列说法正确的是( )| A. | 充电时阳极反应式为:4Cl-+S+SO2-4e-═2SOCl2 | |
| B. | 电池的电解液可用LiCl水溶液代替 | |
| C. | 放电时电子从负极经电解液流向正极 | |
| D. | 该电池放电时,负极发生还原反应 |
分析 A.充电时,阳极上S失电子发生氧化反应;
B.水和Li发生反应生成LiOH和氢气;
C.电子只能在外电路的导线中流动,不会在电解质溶液中流动;
D.放电时,电子从负极沿导线流向正极.
解答 解:A.充电时,阳极上S失电子发生氧化反应,阳极反应式为:4Cl-+S+SO2-4e-=2SOCl2,故A正确;
B.Li是一种碱金属,比较活泼,能与H2O直接发生反应,因此该锂电池的电解液不能用LiCl水溶液代替LiAlCl4-SOCl2,故B错误;
C.放电时,Li是负极,另一个电极是正极,负极上失电子、正极上得电子,所以电子从负极沿导线流向正极,故C错误;
D.放电时Li元素化合价由0价变为+1价,发生氧化反应,故D错误;
故选A.
点评 本题考查了原电池、电解池工作原理,题目难度中等,明确原电池、电解池判断方法是解本题关键,难点是电极反应式的书写,要结合电池反应式及元素化合价变化书写.

练习册系列答案
相关题目
13.碳、氮及其化合物在工农业生产生活中有着重要作用.
已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,这是目前使用最广泛的人工固氮的方法.请回答下列问题:
450℃时,往一个2L的密闭容器中充入2.6molH2和1molN2,反应过程中对NH3的浓度进行检测,得到的数据如表所示
(1)5min内,消耗N2的平均反应速率为0.008mol.L-1.min-1
此条件下该反应的化学平衡常数值为0.1
(2)若改变某一条件,达新平衡时n(H2)=1.6mol,下列说法正确的是BD
A.平衡一定正向移动
B.可能是降低了容器的温度
C.可能是向容器中加入了一定量的H2气体
D.可能是缩小了容器的体积
(3)另一种人工固氮的新方法是在光照条件下,N2在催化剂表面与水蒸气发生反应生成NH3和O2. 已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
2H2(g)+O2(g)=2H2O(g)△H=-489kJ/mol
请根据以上信息,写出人工固氮新方法的热化学方程式2N2(g)+6H2O(g)=4NH3(g)+3O2(g)△H=1282.2KJ/mol
工业上也可在碱性溶液中通过电解的方法实现上述反应,阳极的电极反应式为4OH--4e-=O2↑+2H2O
(4)如图1表示500℃、60.0MPa条件下,合成氨原料气投料比与平衡时NH3体积分数的关系.根据图中a点数据计算N2的平衡体积分数:14.5%.
(5)通过NOx传感器可监测NOx的含量,其工作原理示意图如图2: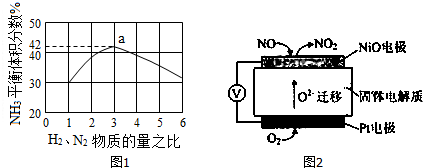
写出NiO电极的电极反应式:NO+O2--2e-=NO2
(6)①2NH3(g)+CO2(g)?NH2COONH4(s),此反应温度越低越容易自发进行,则该反应正向为放热反应(填“吸”或“放”).若将一定量NH2COONH4(s)置于恒温密闭容器中,其分解达到平衡状态,此时容器内压强为P1,混合气体的密度为ρ1.缩小容器的容积,再次达平衡时,容器内压强为P2,混合气体的密度为ρ2.则P1<P2(填“>”“=”或“<”),ρ1<ρ2(填“>”“=”或“<”).
②在恒容绝热(不与外界交换能量)条件下进行2A(g)+B(g)?2C(g)+D(s)反应,按如表数据投料,反应达到平衡状态,测得体系压强升高.简述该反应的平衡常数与温度的变化关系:升高温度平衡常数减小
已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,这是目前使用最广泛的人工固氮的方法.请回答下列问题:
450℃时,往一个2L的密闭容器中充入2.6molH2和1molN2,反应过程中对NH3的浓度进行检测,得到的数据如表所示
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/mol•L-1 | 0.08 | 0.14 | 0.18 | 0.2 | 0.2 | 0.2 |
此条件下该反应的化学平衡常数值为0.1
(2)若改变某一条件,达新平衡时n(H2)=1.6mol,下列说法正确的是BD
A.平衡一定正向移动
B.可能是降低了容器的温度
C.可能是向容器中加入了一定量的H2气体
D.可能是缩小了容器的体积
(3)另一种人工固氮的新方法是在光照条件下,N2在催化剂表面与水蒸气发生反应生成NH3和O2. 已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
2H2(g)+O2(g)=2H2O(g)△H=-489kJ/mol
请根据以上信息,写出人工固氮新方法的热化学方程式2N2(g)+6H2O(g)=4NH3(g)+3O2(g)△H=1282.2KJ/mol
工业上也可在碱性溶液中通过电解的方法实现上述反应,阳极的电极反应式为4OH--4e-=O2↑+2H2O
(4)如图1表示500℃、60.0MPa条件下,合成氨原料气投料比与平衡时NH3体积分数的关系.根据图中a点数据计算N2的平衡体积分数:14.5%.
(5)通过NOx传感器可监测NOx的含量,其工作原理示意图如图2:

写出NiO电极的电极反应式:NO+O2--2e-=NO2
(6)①2NH3(g)+CO2(g)?NH2COONH4(s),此反应温度越低越容易自发进行,则该反应正向为放热反应(填“吸”或“放”).若将一定量NH2COONH4(s)置于恒温密闭容器中,其分解达到平衡状态,此时容器内压强为P1,混合气体的密度为ρ1.缩小容器的容积,再次达平衡时,容器内压强为P2,混合气体的密度为ρ2.则P1<P2(填“>”“=”或“<”),ρ1<ρ2(填“>”“=”或“<”).
②在恒容绝热(不与外界交换能量)条件下进行2A(g)+B(g)?2C(g)+D(s)反应,按如表数据投料,反应达到平衡状态,测得体系压强升高.简述该反应的平衡常数与温度的变化关系:升高温度平衡常数减小
| 物质 | A | B | C | D |
| 起始投料/mol | 2 | 1 | 2 | 0 |
10.下列分子只表示一种物质的是( )
| A. | C3H7Cl | B. | C3H8 | C. | C4H10 | D. | C2H6O |
17.下列实验误差分析正确的是( )
| A. | 用湿润的pH试纸测稀碱液的pH,测定值偏大 | |
| B. | 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小 | |
| C. | 滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小 | |
| D. | 测定中和反应反的应热时,将碱缓慢倒入酸中,所测温度值偏大 |
14.下列实验操作、现象和结论均正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将一铝箔放在酒精灯外焰上灼烧 | 铝箔熔化但不滴落 | 铝箔表面生成致密的Al2O3薄膜,且Al2O3熔点高于Al |
| B | 向某氯化亚铁溶液中加入Na2O2粉末 | 出现红褐色沉淀 | 加入Na2O2粉末前,原氯化 亚铁溶液已经变质 |
| C | 铜放入稀硫酸中,再加入硝酸钠固体 | 开始无明显现象,后溶液变蓝,有明显的气泡放出,铜溶解 | 硝酸钠可以加快铜与稀硫酸的反应速率 |
| D |  | 烧杯中有白色胶状沉淀生成 | 非金属性:N>C>Si |
| A. | A | B. | B | C. | C | D. | D |
12.2015年巴黎气候变化大会召开,旨在保护环境造福人类.下列说法不正确的是( )
| A. | 扩大铅蓄电池、汞锌锰干电池的生产,满足消费需求 | |
| B. | 采用碳捕集和储存技术,逐步实现二氧化碳的零排放 | |
| C. | 对工业废水、生活污水净化处理,减少污染物的排放 | |
| D. | 催化处理汽车尾气,减轻氮氧化物污染和光化学烟雾 |