题目内容
20.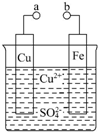 某小组为研究电化学原理,设计如图装置.回答下列问题:
某小组为研究电化学原理,设计如图装置.回答下列问题:(1)a和b不连接时,铁片上发生反应的离子方程式为Fe+Cu2+=Fe2++Cu.
(2)a和b用导线连接时,外电路中的电子是从Fe(填“Fe”或“Cu”)流出,铜极发生的电极反应式为Cu2++2e-=Cu.若反应过程中有0.1mol电子发生转移,铜片上产物的质量为3.2g.
分析 (1)a和b不连接时,会发生金属的化学腐蚀,根据化学反应知识来回答;
(2)a和b用导线连接时,形成原电池的工作原理,根据原电池的工作原理来回答.
解答 解:(1)a和b不连接时,会发生金属铁的化学腐蚀,发生反应为:Fe+Cu2+=Fe2++Cu,故答案为:Fe+Cu2+=Fe2++Cu;
(2)a和b用导线连接时,形成原电池的工作原理,此时活泼金属铁为负极,金属铜为正极,外电路中的电子是从负极流向正极,铜极发生氧化反应,电极反应式为:Cu2++2e-=Cu,若反应过程中有0.1mol电子发生转移,铜片上产物的物质的量为:0.05mol,质量为 3.2 g,故答案为:Fe;Cu2++2e-=Cu; 3.2 g.
点评 本题考查学生化学反应与原电池反应,明确原电池的工作原理及所发生的氧化还原反应是解答本题的关键,电解过程的反应原理应用,难度不大.

练习册系列答案
相关题目
10.常温某无色溶液中,由水的电离产生的C(H+)=1×10-12mol/L,则下列肯定能共存的离子组是( )
| A. | Cu2+ NO3- SO42- Fe3+ | |
| B. | Cl- S2- Na+ K+ | |
| C. | Cl- Na+ NO3- SO42- | |
| D. | SO32- NH4+ K+ Mg2+ |
8.下列实验操作、现象和结论有不正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | SO2通入含紫色石蕊试液的水中 | 溶液先变红后褪色 | SO2有漂白性 |
| B | 将纯Fe(NO3)2样品溶于稀H2SO4中,滴加KSCN溶液 | 溶液变红 | HNO3氧化性强于Fe3+的氧化性 |
| C | 将新制氯水和KI溶液在试管中混合后,加入CCl4,振荡静置 | 溶液分层,下层呈紫色 | 非金属性:Cl>I |
| D | 分别向0.1mol•L-1醋酸和饱和硼酸溶液中滴加0.1mol•L-1Na2CO3溶液 | 醋酸中有气泡产生,硼酸中没有气泡产生 | 酸性:醋酸>碳酸>硼酸 |
| A. | A | B. | B | C. | C | D. | D |
5.相对分子质量均为88的饱和一元醇和饱和一元羧酸发生酯化反应,生成酯的结构可能有(不考虑立体异构)( )
| A. | 8种 | B. | 12种 | C. | 16种 | D. | 32种 |
9.下列物质中既有离子键又有共价键的是 ( )
| A. | MgO | B. | NaOH | C. | CaCl2 | D. | CO2 |
10.下列表示物质结构的化学用语正确的是( )
| A. | 乙酸的结构简式:CH3COOH | B. | Na2O2中氧元素的化合价为-2 | ||
| C. | Cl-的结构示意图: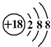 | D. | 乙烯的结构简式CH2CH2 |