题目内容
1. Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.
Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.【实验设计】控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比实验:
(1)请完成以下实验设计表(表中不要留空格)
| 实验编号 | 实验目的 | T/K | pH | c/10-3 mol•L-1 | |
| H2O2 | Fe2+ | ||||
| ① | 为以下实验作参照 | 298 | 3 | 6.0 | 0.30 |
| ② | 探究温度对降解反应速率的影响 | 3 | |||
| ③ | 298 | 10 | 6.0 | 0.30 | |
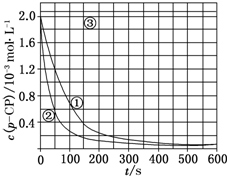
(2)请根据上图实验①曲线,计算降解反应50~150s内的反应速率:v(p-CP)=8.0×10-6mol•L-1•s-1;
【解释与结论】
(3)实验①、②表明温度升高,降解反应速率增大.但后续研究表明:温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:H2O2在温度过高时迅速分解;
(4)实验③得出的结论是:pH等于10时,反应不能(填“能”或“不能”)进行;
【思考与交流】
(5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来.根据上图中的信息,给出一种迅速停止反应的方法:在溶液中加入碱溶液,使溶液的pH大于或等于10.
分析 (1)对比实验的基本思想是控制变量法,可以在温度相同时,变化浓度,或者在浓度相等时,变化温度;
(2)根据反应速率公式V=$\frac{△c}{△t}$计算平均反应速率;
(3)根据过氧化氢在温度较高时易分解的角度分析;
(4)根据图象曲线③的变化判断;
(5)根据曲线③中溶液pH对反应速率的影响角度判断改变的反应条件.
解答 解:(1)对比实验的关键是控制变量,实验②探究温度对降解反应速率的影响,则②中除了温度不同以外,其它量必须与实验①相同,则温度、双氧水浓度、亚铁离子浓度分别为:313K、6.0、0.30;实验③中除了pH与①不同外,其它量完全相同,则探究的是溶液的pH对降解反应速率的影响,
故答案为:
| 实验编号 | 实验目的 | T/K | pH | c/10-3 mol•L-1 | |
| H2O2 | Fe2+ | ||||
| ① | 探究温度对降解反应速率的影响 | 313 | 6.0 | 0.30 | |
| ③ | 探究溶液的pH对降解反应速率的影响 | ||||
则50~150s内的平均反应速率为:v(p-CP)=$\frac{△c}{△t}$=$\frac{(1.2-0.4)×1{0}^{-3}mol•{L}^{-1}}{(150-50)s}$=8.0×10-6 mol/(L.s),
故答案为:8.0×10-6;
(3)温度较高时,过氧化氢不稳定易分解,所以温度过高时反而导致降解反应速率减小,
故答案为:H2O2在温度过高时迅速分解;
(4)通过图象曲线变化可知,当pH=10,随着时间的变化,其浓度基本不变,即反应速率趋向于零(或该降解反应趋于停止),说明pH等于10时的条件下,有机物p-CP不能降解,
故答案为:不能;
(5)根据曲线③可以得出,该反应在pH=10的溶液中停止,故可在反应液中加入碱溶液,使溶液的pH迅速增大,从而使反应停止,
故答案为:在溶液中加入碱溶液,使溶液的pH大于或等于10.
点评 本题考查化学反应速率的影响因素,题目难度中等,注意掌握影响化学反应速率的因素,明确设计对比实验时,只能改变一个条件,否则无法确定影响因素,试题培养了学生的分析、理解能力及化学实验能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.化学反应中,物质的用量不同或浓度不同或反应条件不同会对生成物产生影响.下列反应的生成物不受反应物的用量或浓度或反应条件影响的是( )
| A. | 二氧化硫与氢氧化钠溶液反应 | B. | 钠与氧气的反应 | ||
| C. | 铁在硫蒸气中燃烧 | D. | 铁粉加入硝酸中 |
13.某研究性学习小组向一定量的NaHSO3溶液(加入少量淀粉)中加入稍过量的KIO3溶液,一段时间后,溶液突然变蓝色.为进一步研究有关因素对反应速率的影响,探究如下.
(1)查阅资料 知NaHSO3与过量KIO3反应分为两步进行,且其反应速率主要由第一步反应决定.已知第一步反应的离子方程式为IO3-+3HSO3-═3SO42-+I-+3H+,则第二步反应的离子方程式为IO3-+5I-+6H+=3I2+3H2O.
(2)通过测定溶液变蓝所用时间来探究外界条件对该反应速率的影响,记录如表.
实验①②是探究KIO3溶液的浓度或者浓度对反应速率的影响,表中t1>t2(填“>”、“=”或“<”);
实验①③是探究温度对反应速率的影响,表中a=10.0,b=4.0.
(3)将NaHSO3溶液与KIO3溶液在恒温条件下混合,用速率检测仪检测出起始阶段反应速率逐渐增大.该小组对其原因提出如下假设,请你完成假设二.
假设一:生成的SO42-对反应起催化作用;
假设二:生成的I-或H+对反应起催化作用;
…
(4)请你设计实验验证上述假设一,完成如表中内容.
(1)查阅资料 知NaHSO3与过量KIO3反应分为两步进行,且其反应速率主要由第一步反应决定.已知第一步反应的离子方程式为IO3-+3HSO3-═3SO42-+I-+3H+,则第二步反应的离子方程式为IO3-+5I-+6H+=3I2+3H2O.
(2)通过测定溶液变蓝所用时间来探究外界条件对该反应速率的影响,记录如表.
| 编号 | 0.01mol/LNaHSO3溶液/mL | 0.01mol/L KIO3 溶液/mL | H2O/mL | 反应温度 /℃ | 溶液变蓝所用时间t/s |
| ① | 6.0 | 10.0 | 4.0 | 15 | t1 |
| ② | 6.0 | 14.0 | 0 | 15 | t2 |
| ③ | 6.0 | a | b | 25 | t3 |
实验①③是探究温度对反应速率的影响,表中a=10.0,b=4.0.
(3)将NaHSO3溶液与KIO3溶液在恒温条件下混合,用速率检测仪检测出起始阶段反应速率逐渐增大.该小组对其原因提出如下假设,请你完成假设二.
假设一:生成的SO42-对反应起催化作用;
假设二:生成的I-或H+对反应起催化作用;
…
(4)请你设计实验验证上述假设一,完成如表中内容.
| 实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
| 在烧杯甲中将一定量的NaHSO3溶液与KIO3溶液混合,用速率检测仪测定起始时的反应速率v(甲) 在烧杯乙中先加入少量①Na2SO4粉末,其他条件与甲完全相同,用速率检测仪测定起始时的反应速率v(乙) | ②若v(甲)=v(乙),则假设一不成立 ③若v(甲)<v(乙),则假设一成立 (填“>”、“=”或“<”) |
10.常温某无色溶液中,由水的电离产生的C(H+)=1×10-12mol/L,则下列肯定能共存的离子组是( )
| A. | Cu2+ NO3- SO42- Fe3+ | |
| B. | Cl- S2- Na+ K+ | |
| C. | Cl- Na+ NO3- SO42- | |
| D. | SO32- NH4+ K+ Mg2+ |
