题目内容
在密闭容器中进行如下反应:2SO2(g)+O2(g)═2SO3(g)
SO2的起始浓度是0.4mol/L,O2的起始浓度是1mol/L.当SO2的转化率为80%时,反应达到平衡状态.
(1)求该反应的平衡常数.
(2)若将平衡时反应混合物的压强增大1倍,平衡将如何移动?
(3)若将平衡时反应混合物的压强减小1倍,平衡将如何移动?
(4)平衡时保持体积不变,向平衡混合气体中充入稀有气体Ar,使体系总压变为原来的3倍,平衡又将如何移动?
SO2的起始浓度是0.4mol/L,O2的起始浓度是1mol/L.当SO2的转化率为80%时,反应达到平衡状态.
(1)求该反应的平衡常数.
(2)若将平衡时反应混合物的压强增大1倍,平衡将如何移动?
(3)若将平衡时反应混合物的压强减小1倍,平衡将如何移动?
(4)平衡时保持体积不变,向平衡混合气体中充入稀有气体Ar,使体系总压变为原来的3倍,平衡又将如何移动?
考点:化学平衡的计算
专题:化学平衡专题
分析:SO2的起始浓度是0.4mol/l,当SO2的转化率为80%时,转化的SO2为0.4mol/L×80%=0.32mol/L,
2SO2(g)+O2(g)?2SO3(g)
开始(mol/L) 0.4 1 0
转化(mol/L)0.32 0.16 0.32
平衡(mol/L)0.08 0.84 0.32
(1)根据化学平衡常数的表达式及达到平衡时各组分的浓度平衡常数;
(2)增大压强,平衡向着气体体积缩小的方向移动;
(3)减小压强,平衡向着气体体积增大的方向移动;
(4)容器体积不变,充入稀有气体,对原平衡体系中各组分的浓度没有影响,所以平衡不移动.
2SO2(g)+O2(g)?2SO3(g)
开始(mol/L) 0.4 1 0
转化(mol/L)0.32 0.16 0.32
平衡(mol/L)0.08 0.84 0.32
(1)根据化学平衡常数的表达式及达到平衡时各组分的浓度平衡常数;
(2)增大压强,平衡向着气体体积缩小的方向移动;
(3)减小压强,平衡向着气体体积增大的方向移动;
(4)容器体积不变,充入稀有气体,对原平衡体系中各组分的浓度没有影响,所以平衡不移动.
解答:
解:(1)SO2的起始浓度是0.4mol/l,当SO2的转化率为80%时,转化的SO2为0.4mol/L×80%=0.32mol/L,
2SO2(g)+O2(g)?2SO3(g)
开始(mol/L) 0.4 1 0
转化(mol/L)0.32 0.16 0.32
平衡(mol/L)0.08 0.84 0.32
该反应的平衡常数为:K=
≈19,
答:反应的平衡常数为19;
(2)该反应为气体体积减小的反应,增大压强后,平衡向着正向移动,
答:平衡向正反应方向移动;
(3)该反应为气体体积增大的反应,若将平衡时反应混合物的压强减小1倍,平衡向着气体体积增大逆反应方向移动,
答:平衡向逆反应方向移动;
(4)平衡时保持体积不变,向平衡混合气体中充入稀有气体Ar,使体系总压变为原来的3倍,由于容器体积不变,充入稀有气体后,对原平衡体系中各组分的浓度没有影响,所以平衡不移动,
答:充入稀有气体后,平衡不发生移动.
2SO2(g)+O2(g)?2SO3(g)
开始(mol/L) 0.4 1 0
转化(mol/L)0.32 0.16 0.32
平衡(mol/L)0.08 0.84 0.32
该反应的平衡常数为:K=
| 0.322 |
| 0.84×0.082 |
答:反应的平衡常数为19;
(2)该反应为气体体积减小的反应,增大压强后,平衡向着正向移动,
答:平衡向正反应方向移动;
(3)该反应为气体体积增大的反应,若将平衡时反应混合物的压强减小1倍,平衡向着气体体积增大逆反应方向移动,
答:平衡向逆反应方向移动;
(4)平衡时保持体积不变,向平衡混合气体中充入稀有气体Ar,使体系总压变为原来的3倍,由于容器体积不变,充入稀有气体后,对原平衡体系中各组分的浓度没有影响,所以平衡不移动,
答:充入稀有气体后,平衡不发生移动.
点评:本题考查化学平衡常数的计算、化学平衡的影响因素,题目难度中等,明确化学平衡三段法在化学计算中的应用方法,明确温度、压强对化学平衡的影响.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
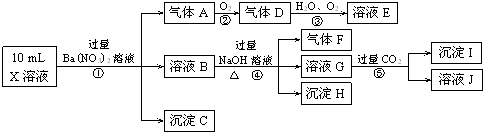
溶液X中可能含有K+、Mg2+、Al3+、AlO2-、SiO32-、CO32-、SO32-、SO42-中的若干种离子.某同学对该溶液进行了如下实验:

下列判断正确的是( )

下列判断正确的是( )
| A、气体甲一定是纯净物 |
| B、沉淀乙为Mg(OH)2 |
| C、沉淀甲是硅酸和硅酸镁的混合物 |
| D、溶液X中一定存在K+、AlO2-和SiO32-离子 |
在298K、100kPa时,已知:2H2O(g)=O2(g)+2H2(g)△H1
Cl2(g)+H2(g)=2HCl(g )△H2
2Cl2(g)+2H2O(g)=4HCl(g)+O2(g)△H3
则△H3与△H1和△H2间的关系正确的是( )
Cl2(g)+H2(g)=2HCl(g )△H2
2Cl2(g)+2H2O(g)=4HCl(g)+O2(g)△H3
则△H3与△H1和△H2间的关系正确的是( )
| A、△H3=△H1+2△H2 |
| B、△H3=△H1+△H2 |
| C、△H3=△H1-2△H2 |
| D、△H3=△H1-△H2 |
如图所示装置可以用来发生、洗涤、干燥、收集(不考虑尾气处理)气体,该装置可用于( )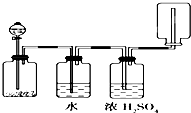

| A、KMnO4分解生成氧气 |
| B、二氧化锰和盐酸生产氯气 |
| C、碳酸钙和盐酸生成二氧化碳 |
| D、锌和盐酸生成氢气 |