题目内容
9.(1)0.5mol H2O的质量为9,其中含有3.01×1023个水分子.(2)质量都是50g的 HCl、NH3、CO2、O2四种气体中,含有分子数目最少的是CO2.在相同温度和相同压强条件下,体积最大的是NH3.
(3)1L 0.2mol/L NaOH溶液中含溶质8g.
分析 (1)m=n•M计算质量,N=n•NA计算分子数,;
(2)$\frac{m}{M}$=n=$\frac{N}{{N}_{A}}$可知,摩尔质量越大,分子数越少,相同温度和相同压强条件下,摩尔质量越小,物质的量越大,体积越大;
(3)根据n=cV,m=nM计算.
解答 解:(1)0.5mol H2O的质量m=0.5mol×18g/mol=9g,其中含有的分子数为0.5mol×6.02×1023mol-1=3.01×1023,
故答案为:9;3.01×1023;
(2)HCl、NH3、CO2、O2四种气体的摩尔质量分别为36.5g/mol、17g/mol、44g/mol、32g/mol,等质量情况下,摩尔质量越大,分子数越少,因此含有分子数最少的是CO2,相同温度和相同压强条件下,摩尔质量越小,物质的量越大,体积越大,因此体积最大的是NH3,
故答案为:CO2;NH3;
(3)1L 0.2mol/L NaOH溶液中,n(NaOH)=0.2mol/L×1L=0.2mol,m(NaOH)=0.2mol×40g/mol=8g,
故答案为:8.
点评 本题考查物质的量有关的计算,题目难度中等,涉及知识点较多、综合性较强,充分考查学生的分析、理解能力及灵活应用基础知识的能力,注意熟练掌握物质的量与阿伏伽德罗常数、摩尔质量等物理量之间的关系.

练习册系列答案
相关题目
7.向含NaBr、NaCl、NaI的混合溶液中通入足量的氯气,充分反应后,将溶液加热蒸干、灼烧,最终获得的残留固体可能是( )
| A. | NaCl NaI | B. | NaCl、I2 | C. | NaCl | D. | NaCl、NaBr、I2 |
8.可用于区别溴蒸气和N02气体的试剂是( )
| A. | KI淀粉溶液 | B. | 蒸馏水 | C. | AgNO3溶液 | D. | NaOH溶液 |
5.X、Y、Z、M 是元素周期表中前20号元素,其原子序数依次增大,且X、Y、Z 相邻.X的核电荷数是Y的核外电子数的一半,Y与M 可形成化合物M2Y.下列说法正确的是( )
| A. | 原子半径:Z>Y | |
| B. | 简单离子的半径:M的离子>Z的离子>Y的离子>X的离子 | |
| C. | X的阴离子和Y的阴离子核外电子数相同 | |
| D. | Z元素的最高价氧化物的水化物的化学式为HZO4 |
4.已知:A(s)+B(g)?2D(g)△H>0,该反应达到平衡后,下列条件的改变有利于平衡向正反应方向移动的是( )
| A. | 升高温度和减小压强 | B. | 降低温度和减小压强 | ||
| C. | 降低温度和增大压强 | D. | 升高温度和增大压强 |
1.在国际相对原子质量表上查得碳的相对原子质量是12.01,这里的12.01是指( )
| A. | 碳元素的平均相对原子质量 | B. | 碳原子质量 | ||
| C. | 同位素C-12的行相原子质量 | D. | C-12的质量数 |
19.下列实验操作中,所用仪器合理的是( )
| A. | 用25ml的碱式滴定管量取14.80mlNaOH溶液 | |
| B. | 用100ml量筒量取5.2ml的盐酸 | |
| C. | 用托盘天平称取25.20gNaCl | |
| D. | 用100ml容量瓶配制50ml1.0mol/L盐酸 |
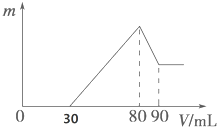 把一定质量的镁、铝混合物投入到1mol•L-1的盐酸中,待金属完全溶解后,向溶液中加入1mol,•L-1的氢氧化钠溶液,生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示.则:
把一定质量的镁、铝混合物投入到1mol•L-1的盐酸中,待金属完全溶解后,向溶液中加入1mol,•L-1的氢氧化钠溶液,生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示.则: