��Ŀ����
������̼����������ЧӦ������Ҫ���ʣ����ܼ��ţ���Ч������Դ���ܹ����ٶ�����̼���ŷţ�
��1����һ���¶��µ�2L�̶��ݻ����ܱ������У�ͨ��2molCO2��3mol H2�������ķ�ӦΪ��CO2��g��+3H2��g��?CH3OH��g��+H2O��g������H=-a kJ?mol-1��a��0�������CO2��g����CH3OH��g����Ũ����ʱ��仯��ͼ1��ʾ��

����˵���÷�Ӧ�Ѵ�ƽ��״̬���� ����ѡ���ţ�
A��CO2����������ڻ�������б��ֲ���
B����������ƽ����Է�����������ʱ��ı仯���仯
C����λʱ����ÿ����1.2mol H2��ͬʱ����0.4molH2O
D������ϵ��H2O��CH3OH�����ʵ���Ũ��֮��Ϊ1��1���ұ��ֲ���
�ڼ�����¶��´˷�Ӧ��ƽ�ⳣ��K= ����������λ��Ч���֣������ı����� ����ѡ�����ʹK=1��
A������ѹǿ B������Ӧ��Ũ�� C�������¶�D�������¶� E���������
��2��ij�״�ȼ�ϵ��ԭ����ͼ2��ʾ��
��M��������Ӧ�ĵ缫��ӦʽΪ ��
���������������Դ����ͼ3װ�õ�ⱥ��ʳ��ˮ���缫��Ϊ���Ե缫������õ����ܷ�Ӧ���ӷ���ʽΪ�� ��������Һ���Ϊ300mL������Һ��pHֵ��Ϊ13ʱ���ڳ����²ⶨ�������������ļ״�������Ϊ ��������Һ����仯����
��3����һ����CO2�����״�ȼ�ϵķ�����
��֪��CO2��g��+3H2��g��?CH3OH��g��+H2O��g����H=-a kJ?mol-1��
CH3OH��g��=CH3OH��l����H=-b kJ?mol-1��
2H2��g��+O2��g��=2H2O��g����H=-c kJ?mol-1��
H2O��g��=H2O��l����H=-d kJ?mol-1��
���ʾCH3OH��l��ȼ���ȵ��Ȼ�ѧ����ʽΪ�� ��
��1����һ���¶��µ�2L�̶��ݻ����ܱ������У�ͨ��2molCO2��3mol H2�������ķ�ӦΪ��CO2��g��+3H2��g��?CH3OH��g��+H2O��g������H=-a kJ?mol-1��a��0�������CO2��g����CH3OH��g����Ũ����ʱ��仯��ͼ1��ʾ��

����˵���÷�Ӧ�Ѵ�ƽ��״̬����
A��CO2����������ڻ�������б��ֲ���
B����������ƽ����Է�����������ʱ��ı仯���仯
C����λʱ����ÿ����1.2mol H2��ͬʱ����0.4molH2O
D������ϵ��H2O��CH3OH�����ʵ���Ũ��֮��Ϊ1��1���ұ��ֲ���
�ڼ�����¶��´˷�Ӧ��ƽ�ⳣ��K=
A������ѹǿ B������Ӧ��Ũ�� C�������¶�D�������¶� E���������
��2��ij�״�ȼ�ϵ��ԭ����ͼ2��ʾ��
��M��������Ӧ�ĵ缫��ӦʽΪ
���������������Դ����ͼ3װ�õ�ⱥ��ʳ��ˮ���缫��Ϊ���Ե缫������õ����ܷ�Ӧ���ӷ���ʽΪ��
��3����һ����CO2�����״�ȼ�ϵķ�����
��֪��CO2��g��+3H2��g��?CH3OH��g��+H2O��g����H=-a kJ?mol-1��
CH3OH��g��=CH3OH��l����H=-b kJ?mol-1��
2H2��g��+O2��g��=2H2O��g����H=-c kJ?mol-1��
H2O��g��=H2O��l����H=-d kJ?mol-1��
���ʾCH3OH��l��ȼ���ȵ��Ȼ�ѧ����ʽΪ��
���㣺���ʵ�����Ũ����ʱ��ı仯����,�ø�˹���ɽ����йط�Ӧ�ȵļ���,ԭ��غ͵��صĹ���ԭ��,��ѧƽ���Ӱ������,��ѧƽ��״̬���ж�
ר�⣺
��������1���ٻ�ѧ��Ӧ�ﵽ��ѧƽ��״̬ʱ�����淴Ӧ������ȣ��Ҳ�����0�������ʵ�Ũ�Ȳ��ٷ����仯���ɴ�������һЩ�������������仯���Դ˽����жϣ�
�ڸ���ͼ�����ݽ��ƽ�ⳣ��K�ļ��㹫ʽ���м��㣬����K�����¶��йؼ���ӦΪ�������жϸı�������
��2�������ȸ��������ӵ��ƶ�������ȷ����������Ȼ�����ԭ���ԭ����д�缫��Ӧʽ��
��������·��ת�Ƶ��ӵ���Ŀ��ȣ����Ը��ݵ���ת�Ƶ���Ŀ��ͬ���г���֪���ʺ�δ֪����֮���ϵʽ��Ȼ��ͨ����ϵ����⣻
��3�����ݸ�˹���ɽ��м��㣬��д�Ȼ�ѧ����ʽ��
�ڸ���ͼ�����ݽ��ƽ�ⳣ��K�ļ��㹫ʽ���м��㣬����K�����¶��йؼ���ӦΪ�������жϸı�������
��2�������ȸ��������ӵ��ƶ�������ȷ����������Ȼ�����ԭ���ԭ����д�缫��Ӧʽ��
��������·��ת�Ƶ��ӵ���Ŀ��ȣ����Ը��ݵ���ת�Ƶ���Ŀ��ͬ���г���֪���ʺ�δ֪����֮���ϵʽ��Ȼ��ͨ����ϵ����⣻
��3�����ݸ�˹���ɽ��м��㣬��д�Ȼ�ѧ����ʽ��
���
�⣺��1����CO2��g��+3H2��g��?CH3OH��g��+H2O��g����
A��CO2����������ڻ�������б��ֲ��䣬����˵���ﵽƽ��״̬����A��ȷ��
B��ƽ����Է�������=
��������һ���������ʵ�����䣬�ʻ�������ƽ����Է�����������ʱ��ı仯���仯˵���ﵽƽ��״̬����B��ȷ��
C����λʱ����ÿ����1.2mol H2��ͬʱ����0.4molH2O�������������淴Ӧ���ʲ���˵���ﵽƽ��״̬����C����
D��H2O��CH3OH���Dz�����Ұ���1��1�ı������ɣ�����H2O��CH3OH�����ʵ���Ũ��֮��һֱΪ1��1������˵���ﵽƽ��״̬����D����
�ʴ�Ϊ��AB��
����ͼ������CO2��g��+3H2��g��?CH3OH��g��+H2O��g����
��ʼŨ�ȣ�1 1.5 0 0
ת��Ũ�ȣ�0.25 0.75 0.25 0.25
ƽ��Ũ�ȣ�0.75 0.75 0.25 0.25
����K=
=0.20��
ƽ�ⳣ�����¶ȵĺ�����ֻ��ͨ���ı��¶ȣ����ı�ƽ�ⳣ��������Ӧ�Ƿ��ȷ�Ӧ�������¶�ʹƽ��������Ӧ�����ƶ���Kֵ���
�ʴ�Ϊ��0.20��C��
��2����M��������������һ����Ӧ��ԭ��صĸ���������������Ӧ���缫��ӦʽΪ��CH3OH-6e-+H2O=CO2+6H+��
�ʴ�Ϊ��CH3OH-6e-+H2O=CO2+6H+��
���ö��Ե缫����ⱥ��ʳ��ˮ�ܵĵ缫��ӦʽΪ2Cl-+2H2O
H2��+Cl2��+2OH-��
pHֵ��Ϊ13ʱ��pOH=1��c��OH-��=0.1mol/L��n��OH-��=0.1mol/L��0.3L=0.03mol���ɷ���ʽCH3OH-6e-+H2O=CO2+6H+��2Cl-+2H2O
H2��+Cl2��+2OH-��֪
CH3OH��6e-��6OH-
32g 6mol
m��CH3OH�� 0.03mol
��m��CH3OH��=32g��0.03mol��6mol=0.16g��
�ʴ�Ϊ��2Cl-+2H2O
H2��+Cl2��+2OH-��0.16g��
��3����CO2��g��+3H2��g��?CH3OH��g��+H2O��g����H=-a kJ?mol-1��
��CH3OH��g��=CH3OH��l����H=-b kJ?mol-1��
��2H2��g��+O2��g��=2H2O��g����H=-c kJ?mol-1��
��H2O��g��=H2O��l����H=-d kJ?mol-1��
�ɢۡ�
+�ܡ�2-��-�ٵã�CH3OH��l��+
O2��g��=CO2��g��+2H2O��l������H=-��
c+2d-a-b��kJ?mol-1��
�ʴ�Ϊ��CH3OH��l��+
O2��g��=CO2��g��+2H2O��l����H=-��
c+2d-a-b��kJ?mol-1��
A��CO2����������ڻ�������б��ֲ��䣬����˵���ﵽƽ��״̬����A��ȷ��
B��ƽ����Է�������=
| ������ |
| �����ʵ��� |
C����λʱ����ÿ����1.2mol H2��ͬʱ����0.4molH2O�������������淴Ӧ���ʲ���˵���ﵽƽ��״̬����C����
D��H2O��CH3OH���Dz�����Ұ���1��1�ı������ɣ�����H2O��CH3OH�����ʵ���Ũ��֮��һֱΪ1��1������˵���ﵽƽ��״̬����D����
�ʴ�Ϊ��AB��
����ͼ������CO2��g��+3H2��g��?CH3OH��g��+H2O��g����
��ʼŨ�ȣ�1 1.5 0 0
ת��Ũ�ȣ�0.25 0.75 0.25 0.25
ƽ��Ũ�ȣ�0.75 0.75 0.25 0.25
����K=
| 0.25��0.25 |
| 0.75��0.753 |
ƽ�ⳣ�����¶ȵĺ�����ֻ��ͨ���ı��¶ȣ����ı�ƽ�ⳣ��������Ӧ�Ƿ��ȷ�Ӧ�������¶�ʹƽ��������Ӧ�����ƶ���Kֵ���
�ʴ�Ϊ��0.20��C��
��2����M��������������һ����Ӧ��ԭ��صĸ���������������Ӧ���缫��ӦʽΪ��CH3OH-6e-+H2O=CO2+6H+��
�ʴ�Ϊ��CH3OH-6e-+H2O=CO2+6H+��
���ö��Ե缫����ⱥ��ʳ��ˮ�ܵĵ缫��ӦʽΪ2Cl-+2H2O
| ||
pHֵ��Ϊ13ʱ��pOH=1��c��OH-��=0.1mol/L��n��OH-��=0.1mol/L��0.3L=0.03mol���ɷ���ʽCH3OH-6e-+H2O=CO2+6H+��2Cl-+2H2O
| ||
CH3OH��6e-��6OH-
32g 6mol
m��CH3OH�� 0.03mol
��m��CH3OH��=32g��0.03mol��6mol=0.16g��
�ʴ�Ϊ��2Cl-+2H2O
| ||
��3����CO2��g��+3H2��g��?CH3OH��g��+H2O��g����H=-a kJ?mol-1��
��CH3OH��g��=CH3OH��l����H=-b kJ?mol-1��
��2H2��g��+O2��g��=2H2O��g����H=-c kJ?mol-1��
��H2O��g��=H2O��l����H=-d kJ?mol-1��
�ɢۡ�
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
�ʴ�Ϊ��CH3OH��l��+
| 3 |
| 2 |
| 3 |
| 2 |
���������⿼�黯ѧƽ��״̬���жϡ�ƽ�ⳣ���ļ��㡢��ѧƽ���Ӱ�����ء��缫��Ӧʽ�����ӷ���ʽ����д���Լ���˹���ɵ�Ӧ�õ�֪ʶ���ۺ���ǿ���ѶȽϴ�

��ϰ��ϵ�д�
 �п�������㾫��ϵ�д�
�п�������㾫��ϵ�д�
�����Ŀ
ƻ����Ľṹ��ʽ��ͼ��ʾ������˵��������ǣ�������


| A��ƻ�������ܷ���������Ӧ�Ĺ����ŵ���Ŀ��3�� |
| B��1molƻ�������2molNaOH�����кͷ�Ӧ |
| C��1molƻ��������������Na��Ӧ����1.5molH2 |
| D��H OOCCH2-CH��COOH��-OH��ƻ�����Dz�ͬ������ |
�����йػ�ѧ����˵����ȷ���ǣ�������
| A����ѧ��������ԭ�Ӽ��������� |
| B�����Ӽ�������������ͨ�����������γɵĻ�ѧ�� |
| C�����ۼ�ֻ�����ڹ��ۻ������� |
| D���ǽ���Ԫ�ص�ԭ��֮�䲻�����γ����Ӽ� |
 �����£���0.1mol?L-1NaAlO2��Һ����μ���0.1mol?L-1ϡ���ᣬʵ������ҺpH����������仯��������ͼ�������й�˵����ȷ���ǣ�������
�����£���0.1mol?L-1NaAlO2��Һ����μ���0.1mol?L-1ϡ���ᣬʵ������ҺpH����������仯��������ͼ�������й�˵����ȷ���ǣ�������A��a��ʱ����Һ�ʼ��Ե�ԭ����Al
| ||||
B��a��b�Σ���ҺpH��С��Al
| ||||
| C��b��c�Σ������������Ҫ��������Al��OH��3���� | ||||
| D��d��ʱ��Al��OH��3������ʼ�ܽ� |
�н�����װ���еĵ��ɼв�������ز��������������У�������Ӧװ��©�����ǣ�������
A��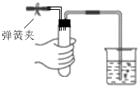 ��ͼװ���У�������ס�Թܣ��ձ��г������ݣ��ַſ��������γ�һ���ȶ���ˮ�� |
B�� ��ͼװ���У���©���м�һ����ˮ�����γ�ˮ�������ˮ���½���ƿ��Һ����ƽ |
C�� ��ͼװ���У�˫����ס��ƿ���������γ�һ���ȶ���ˮ����˫�ַſ���ˮ���������� |
D�� ��ͼװ���У���a����������һ�θ߶ȣ�a��b����֮��ˮ���γ��ȶ��ĸ߶Ȳ� |
�ס��ҡ�������ѧ��ѧ�������ʣ�һ���������ܷ���ת������+ǿ�����+��+H2O��������Ϊ�Σ���Ϊ���壮����˵����ȷ���ǣ�������
| A����һ���ǽ������� |
| B��������һ������ͬ��Ԫ�� |
| C����һ���������� |
| D���÷�Ӧһ����������ԭ��Ӧ |
�����ĩX�п��ܺ���Cu��FeO��Fe2O3��NaHCO3��Na2CO3��Na2S2O3��NaAlO2�е������֣�ij��ѧ��ȤС��Ϊȷ���ù����ĩ�ijɷ֣���ȡX��������ʵ�飬ʵ����̼��������£�
��֪��HCO3-+AlO2-+H2O�TAl ��OH��3��+CO32-
����˵����ȷ���ǣ�������

��֪��HCO3-+AlO2-+H2O�TAl ��OH��3��+CO32-
����˵����ȷ���ǣ�������

| A�������Һ��������Ϊ������ |
| B�������ĩX��һ������FeO��Na2S2O3��NaAlO2�����ܺ���Na2CO3��NaHCO3 |
| C����Һ���е�������һ��ֻ��H+��Fe2+ |
| D����Һ����һ������AlO2-�����ܺ���CO32- |

 A��B��C��D��E��F��ԭ���������ε�����ǰ������Ԫ�أ�A�������к�����ḻ��Ԫ�أ�D��Eͬ���壬��E��ԭ��������D��������B��D��ɵĻ�������һ���������壻CԪ��ԭ�������P�ܼ���S�ܼ���1�����ӣ�Fԭ�ӵ�������������A��ͬ�����������������ݴ˻ش��������⣮
A��B��C��D��E��F��ԭ���������ε�����ǰ������Ԫ�أ�A�������к�����ḻ��Ԫ�أ�D��Eͬ���壬��E��ԭ��������D��������B��D��ɵĻ�������һ���������壻CԪ��ԭ�������P�ܼ���S�ܼ���1�����ӣ�Fԭ�ӵ�������������A��ͬ�����������������ݴ˻ش��������⣮