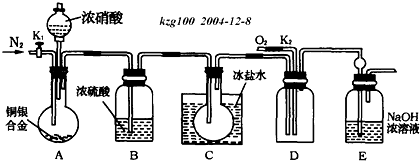
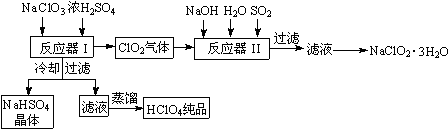
题目内容
13gZn与100mL稀HCl恰好完全反应.求:
(1)标准状况下生成H2的体积;
(2)生成ZnCl2的物质的量
(3)原稀HCl的物质的量浓度.
(4)用双线侨法表示该反应中电子转移的方向和数目.
(1)标准状况下生成H2的体积;
(2)生成ZnCl2的物质的量
(3)原稀HCl的物质的量浓度.
(4)用双线侨法表示该反应中电子转移的方向和数目.
考点:化学方程式的有关计算
专题:计算题
分析:发生反应:Zn+2HCl=ZnCl2+H2↑,根据n=
计算13g Zn的物质的量,再根据方程式计算生成氢气的物质的量,生成氯化锌的物质的量,HCl的物质的量,根据V=nVm计算氢气体积,根据c=
计算盐酸的浓度,利用双线桥表示电子转移,由反应物指向生成物,表示同种元素之间电子得失情况,并注明电子转移数目.
| m |
| M |
| n |
| V |
解答:
解:13g Zn的物质的量为
=0.2mol,
Zn+2 HCl=ZnCl2+H2↑,
0.2mol 0.4mol 0.2mol 0.2mol
故标况下,生成氢气体积为0.2mol×22.4L/mol=4.48L,
生成氯化锌的物质的量为0.2mol,
盐酸的浓度为
=4mol/L,
标出电子转移方向与数目为: ,
,
答:(1)标准状况下生成H2的体积为4.48L;
(2)生成ZnCl2的物质的量为0.2mol;
(3)原稀HCl的物质的量浓度为4mol/L.
(4)用双线侨法表示该反应中电子转移的方向和数目为 .
.
| 13g |
| 65g/mol |
Zn+2 HCl=ZnCl2+H2↑,
0.2mol 0.4mol 0.2mol 0.2mol
故标况下,生成氢气体积为0.2mol×22.4L/mol=4.48L,
生成氯化锌的物质的量为0.2mol,
盐酸的浓度为
| 0.4mol |
| 0.1L |
标出电子转移方向与数目为:
 ,
,答:(1)标准状况下生成H2的体积为4.48L;
(2)生成ZnCl2的物质的量为0.2mol;
(3)原稀HCl的物质的量浓度为4mol/L.
(4)用双线侨法表示该反应中电子转移的方向和数目为
 .
.
点评:本题考查化学方程式有关计算、氧化还原反应表示,比较基础,注意对基础知识的理解掌握.

练习册系列答案
相关题目
要使NH4Cl溶液中c(NH4+)=c(Cl-),可向其中加入:( )
| A、NaOH |
| B、盐酸 |
| C、Na2CO3 |
| D、CH3COONH4 |
下列表示正确的是( )
A、N2的电子式: |
B、CS2分子的球棍模型: |
C、邻羟基苯甲酸的结构简式: |
D、苯的比例模型: |
SF6是一种优良的绝缘气体材料,分子结构中只存在S-F键.已知:1molS(s)转化为气态硫原子时吸收能量280kJ,形成1molF-F、S-F键需放出的能量分别为160kJ、330kJ.则S(s)+3F2(g)=SF6(g)的反应热△H为( )
| A、-720kJ/mol |
| B、+430kJ/mol |
| C、-450kJ/mol |
| D、-1220kJ/mol |
在烃分子中去掉2个氢原子变成碳碳双键是吸热反应,而1,3-环己二烯失去了2个氢原子,变成苯是放热反应,根据以上信息判断下列问题正确的是( )
| A、1,3-环己二烯比苯稳定 |
| B、苯比1,3-环己二烯稳定 |
| C、1,3-环己二烯加氢是吸热反应 |
| D、苯加氢生成环己烷是吸热反应 |
NA代表阿伏加德罗常数的数值,下列说法正确的是( )
| A、常温常压下,14 g N2含有的分子数为0.5NA |
| B、0.1mol/L的NaOH溶液中含钠离子数为0.1NA |
| C、6.72L NO2与足量H2O反应,转移的电子数为0.1NA |
| D、0.30mol Fe粉与足量水蒸气反应生成H2的物质的量为0.4NA |
下列各式中,属于正确的电离方程式的是( )
| A、HCO3-+H2O?H2CO3+OH- |
| B、CH3COONa?CH3COO-+Na+ |
| C、Ca(OH)2?Ca2++2OH- |
| D、NH3?H2O?NH4++OH- |