题目内容
NA代表阿伏加德罗常数的数值,下列说法正确的是( )
| A、常温常压下,14 g N2含有的分子数为0.5NA |
| B、0.1mol/L的NaOH溶液中含钠离子数为0.1NA |
| C、6.72L NO2与足量H2O反应,转移的电子数为0.1NA |
| D、0.30mol Fe粉与足量水蒸气反应生成H2的物质的量为0.4NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、依据n=
计算物质的量计算分子数;
B、溶液体积不明确;
C、气体所处的状态不明确;
D、根据化学反应方程式进行分析计算.
| m |
| M |
B、溶液体积不明确;
C、气体所处的状态不明确;
D、根据化学反应方程式进行分析计算.
解答:
解:A、14g N2含物质的量n=
=0.5mol,含有的分子数为0.5NA,故A正确;
B、溶液体积不明确,故无法计算溶液中钠离子的个数,故B错误;
C、气体所处的状态不明确,物质的量不一定为0.3mol,故C错误;
D、红热的铁与水蒸气可发生反应:3Fe+4H2O(g)
Fe3O4+4H2,0.3molFe粉与足量水蒸气反应,生成0.4molH2,生成的H2分子数为0.4NA,故D正确;
故选AD.
| 14g |
| 28g/mol |
B、溶液体积不明确,故无法计算溶液中钠离子的个数,故B错误;
C、气体所处的状态不明确,物质的量不一定为0.3mol,故C错误;
D、红热的铁与水蒸气可发生反应:3Fe+4H2O(g)
| ||
故选AD.
点评:本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
下列分子中,所有原子都可能处在同一平面的是( )
| A、1,3-丁二烯 | B、丙炔 |
| C、环已烯 | D、甲苯 |
根据元素周期表和元素周期律分析下面的推断,其中正确的是( )
| A、锂、钠、钾的原子半径逐渐增大 |
| B、钠比镁活泼 |
| C、溴单质的氧化性比氯气强 |
| D、氢氧化钠比氢氧化钾的碱性强 |
下列反应中生成物总能量高于反应物总能量的是( )
| A、碳酸钙受热分解 |
| B、乙醇燃烧 |
| C、铝粉与盐酸反应 |
| D、中和反应 |
由0.2g氢气,2.8g氮气,0.4g氦气(He),3.2g氧气组成的混合气体在0℃,1.01×105Pa下所占的体积为( )
| A、7.84L |
| B、8.96L |
| C、15.68L |
| D、17.92L |
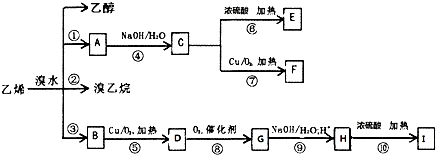
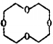 I的分子式为C4H4O4,是一种环状化合物.请回答下列问题:
I的分子式为C4H4O4,是一种环状化合物.请回答下列问题: