题目内容
欲用浓硝酸法(测定反应后生成气体的量)测定某铜银合金中铜的质量分数,但资料表明:①反应中除生成NO2气体外还会有少量的NO生成;②常温下NO2和N2O4混合存在,在低于0℃时几乎只有无色的N2O4液体或晶体存在.为完成测定并验证确有NO生成,有人设计如下实验装置.
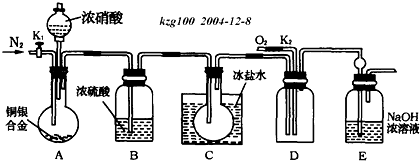
(1)实验开始前要先打开A部分的活塞K1,持续通一段时间的氮气再关闭K1,这样做的目的是 .
(2)装置B瓶的作用是 .
(3)A中的反应停止后,打开D中的活塞K2,并通入氧气,若反应确有NO产生,则D中应出现的现象是 ;实验发现,通入氧气温度的高低对实验现象有较大影响,则为便于观察应通入 (填“冷”或“热”)的氧气.
(4)为减小测量误差,在A中反应完成和D中出现现象后,还应继续进行的操作是 .
(5)实验测得下列数据:所用铜银合金质量:15.0g、浓硝酸:40mL13.5mol/L;实验后A中溶液体积:40mL、H+浓度1.0mol/L.若设反应中硝酸既无挥发也无分解,则:
①参加反应的硝酸的物质的量为 ;
②若已测出反应后E装置的生成物中含氮元素的质量,则为确定合金中铜的质量分数还需要测定的数据是 .

(1)实验开始前要先打开A部分的活塞K1,持续通一段时间的氮气再关闭K1,这样做的目的是
(2)装置B瓶的作用是
(3)A中的反应停止后,打开D中的活塞K2,并通入氧气,若反应确有NO产生,则D中应出现的现象是
(4)为减小测量误差,在A中反应完成和D中出现现象后,还应继续进行的操作是
(5)实验测得下列数据:所用铜银合金质量:15.0g、浓硝酸:40mL13.5mol/L;实验后A中溶液体积:40mL、H+浓度1.0mol/L.若设反应中硝酸既无挥发也无分解,则:
①参加反应的硝酸的物质的量为
②若已测出反应后E装置的生成物中含氮元素的质量,则为确定合金中铜的质量分数还需要测定的数据是
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:实验开始前要先打开A部分的活塞K1,持续通一段时间的氮气再关闭K1,排尽装置中的空气,滴入浓硝酸反应生成二氧化氮和一氧化氮气体,干燥后通过装置C,在低于0℃时几乎只有无色的N2O4液体或晶体存在,A中的反应停止后,打开D中的活塞K2,并通入氧气,若反应确有NO产生,则D中出现红棕色气体,说明有一氧化氮气体生成,剩余气体用氢氧化钠溶液吸收;
(1)通入氮气是排除装置中的空气,避免生成的一氧化氮气体被氧化为二氧化氮;
(2)B装置是利用浓硫酸的吸水性吸收气体中的水蒸气避免在C中 冷却后水和二氧化氮反应生成一氧化氮;
(3)一氧化氮和氧气反应生成红棕色气体二氧化氮气体;温度高反应速率快;
(4)由于装置中有残留的气体,所以要打开K1、K2持续通入一段时间的N2和O2,以把气体完全排尽;
(5)①硝酸的总的物质的量是0.54mol,剩余硝酸是0.04mol,所以参加反应的硝酸是0.54mol-0.04mol=0.5mol;
②要计算铜质量分数,还需要计算出生成的N2O4的质量,所以还需要测量C中烧烧瓶在实验前后增加的质量;
(1)通入氮气是排除装置中的空气,避免生成的一氧化氮气体被氧化为二氧化氮;
(2)B装置是利用浓硫酸的吸水性吸收气体中的水蒸气避免在C中 冷却后水和二氧化氮反应生成一氧化氮;
(3)一氧化氮和氧气反应生成红棕色气体二氧化氮气体;温度高反应速率快;
(4)由于装置中有残留的气体,所以要打开K1、K2持续通入一段时间的N2和O2,以把气体完全排尽;
(5)①硝酸的总的物质的量是0.54mol,剩余硝酸是0.04mol,所以参加反应的硝酸是0.54mol-0.04mol=0.5mol;
②要计算铜质量分数,还需要计算出生成的N2O4的质量,所以还需要测量C中烧烧瓶在实验前后增加的质量;
解答:
解:(1)通入氮气是排除装置中的空气,避免生成的一氧化氮气体被氧化为二氧化氮;
故答案为:排尽装置中的空气;
(2)B装置是利用浓硫酸的吸水性吸收气体中的水蒸气避免在C中冷却后水和二氧化氮反应生成一氧化氮,
故答案为:吸收水蒸气,防止水蒸气在C中冷凝后与NO2反应产生NO;
(3)A中的反应停止后,打开D中的活塞K2再通入氧气,若反应中确有NO产生,一氧化氮和氧气反应生成红棕色气体二氧化氮气体,通入氧气温度越高反应速率越快,通入热的氧气,
故答案为:出现红棕色气体;热;
(4)由于装置中有残留的气体,所以在A中反应完成和D中出现现象后还须进行的操作是:打开K1、K2持续通入一段时间的N2和O2,以把气体完全排尽;
故答案为:打开K1、K2持续通入一段时间的N2和O2;
(5)①硝酸的总的物质的量是0.54mol,剩余硝酸是0.04mol,所以参加反应的硝酸是0.54mol-0.04mol=0.50mol,
故答案为:0.50mol;
②要计算铜质量分数,还需要计算出生成的N2O4的质量.所以还需要测量C中烧烧瓶在实验前后增加的质量,
故答案为:C中圆底烧瓶在实验前后增加的质量;
故答案为:排尽装置中的空气;
(2)B装置是利用浓硫酸的吸水性吸收气体中的水蒸气避免在C中冷却后水和二氧化氮反应生成一氧化氮,
故答案为:吸收水蒸气,防止水蒸气在C中冷凝后与NO2反应产生NO;
(3)A中的反应停止后,打开D中的活塞K2再通入氧气,若反应中确有NO产生,一氧化氮和氧气反应生成红棕色气体二氧化氮气体,通入氧气温度越高反应速率越快,通入热的氧气,
故答案为:出现红棕色气体;热;
(4)由于装置中有残留的气体,所以在A中反应完成和D中出现现象后还须进行的操作是:打开K1、K2持续通入一段时间的N2和O2,以把气体完全排尽;
故答案为:打开K1、K2持续通入一段时间的N2和O2;
(5)①硝酸的总的物质的量是0.54mol,剩余硝酸是0.04mol,所以参加反应的硝酸是0.54mol-0.04mol=0.50mol,
故答案为:0.50mol;
②要计算铜质量分数,还需要计算出生成的N2O4的质量.所以还需要测量C中烧烧瓶在实验前后增加的质量,
故答案为:C中圆底烧瓶在实验前后增加的质量;
点评:本题考查了物质性质的实验设计,硝酸性质的应用,实验步骤和产物性质及其反应现象是解题关键,题目难度中等.

练习册系列答案
相关题目
下列措施符合“绿色化学”思想的是( )
| A、直接排放含磷生活污水 |
| B、大量使用氟里昂作为冰箱制冷剂 |
| C、使用可降解塑料代替不可降解塑料 |
| D、使用不易分解的有机氯农药 |
已知X、Y元素同周期,且第一电离能X>Y,下列说法不正确的是( )
| A、电负性Y小于X |
| B、X与Y形成化合物时,X显负价,Y显正价 |
| C、最高价含氧酸的酸性:X对应的酸性弱于Y对应的酸性 |
| D、气态氢化物的稳定性:HmY小于HnX |
 某物质只含C、H、O三种元素,其分子模型如右图所示,分子中共有12个原子(图中球与球之间的连线代表化学键:单键、双键等).
某物质只含C、H、O三种元素,其分子模型如右图所示,分子中共有12个原子(图中球与球之间的连线代表化学键:单键、双键等).
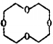 I的分子式为C4H4O4,是一种环状化合物.请回答下列问题:
I的分子式为C4H4O4,是一种环状化合物.请回答下列问题: