题目内容
17.下列说法正确的是( )| A. | 钢件表面镀锌时,钢件与外电源的正极相连 | |
| B. | 由反应 (g)+H2(g)→ (g)+H2(g)→ (g)△H=+28.7kJ.mol-1,则环已二烯比苯稳定 (g)△H=+28.7kJ.mol-1,则环已二烯比苯稳定 | |
| C. | 常温时,pH=11的氨水与pH=3的盐酸等体积混合,所得溶液pH>7 | |
| D. | 合成氨反应N2+3H2?2NH3,当满足v(N2)逆:v(H2)逆:v(NH3)逆=1:3:2时,标志该反应已达到平衡状态 |
分析 A.电镀时,镀件金属接电源的负极;
B.△H>0,是一个吸热反应,说明反应物的总能量低于生成物的总能量,能量越低越稳定;
C.pH=11的氨水溶液,氨水浓度大于0.001mol/L,pH=3的盐酸溶液浓度是0.001mol/L,等体积混合,氨水过量,导致溶液呈碱性;
D.反应到达平衡状态时,正逆反应速率相等.
解答 解:A.钢件镀锌时,钢件与外电源的负极相连作阴极,锌片与电源正极相连作阳极,故A错误;
B.△H>0,是一个吸热反应,说明反应物的总能量低于生成物的总能量,可知 比
比 能量低,能量越低越稳定,所以
能量低,能量越低越稳定,所以 更稳定,故B错误;
更稳定,故B错误;
C.pH=11的氨水溶液,氨水浓度大于0.001mol/L,pH=3的盐酸溶液浓度是0.001mol/L,等体积混合,氨水过量,导致溶液呈碱性,所得溶液pH>7,故C正确;
D.v(N2)逆:v(H2)逆:v(NH3)逆=1:3:2,是同一方向的速率之比,不代表正逆反应速率相等,不能说明一定达平衡,故D错误;
故选C.
点评 本题考查了电镀原理、平衡状态标志的判断、酸碱混合pH的大小等,明确酸碱混合后溶液中的溶质及pH与浓度的关系是解答本题的关键,题目难度中.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
7.下列化学用语表述正确的是( )
| A. | 羟基的电子式: | B. | 硝基苯的结构简式: | ||
| C. | 四氯化碳的球棍模型: | D. | NH4Br的电子式: |
8.下列关于价电子构型3s23p4的描述正确的是( )
| A. | 该元素的电负性是同主族最大的 | |
| B. | 其轨道表示式为 | |
| C. | 可以与H2化合生成液态化合物 | |
| D. | 它的核外电子排布式为1s22s22p63s23p4 |
5.含NO3-的工业废水会造成水体富营养化,可利用如下反应将其转化为NH3:Al+口+口+口→口+口,反应中涉及到的另外3种微粒是H2O、AlO2-、OH-.下列说法正确的是( )
| A. | 反应中的Al被还原,NO3-是还原剂 | |
| B. | 产物分别是NH3、AlO2-和OH- | |
| C. | 若有4mol Al参加反应,则有1.5mol NO3-被还原 | |
| D. | 随着反应的进行,溶液的碱性逐渐增强 |
12.将7.28g Fe溶于过量的稀H2SO4中,在加热的条件下,用2.02gKNO3去氧化溶液中Fe2+,待反应完全后,剩余Fe2+还需0.4mol/L KMnO4溶液25mL才能完全氧化,则KNO3的还原产物( )
| A. | NO | B. | NO2 | C. | N2O | D. | N2O3 |
2.表是A、B、C、D、E五种有机物的有关信息:
根据表中信息回答下列问题:
(1)A与溴水反应的生成物的名称叫做1,2-二溴乙烷;写出在一定条件下,A生成高分子化合物的化学方程式: .
.
(2)A与氢气发生加成反应后生成分子F,与F在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2.当n=4时,这类有机物开始出现同分异构体.
(3)B具有的性质是②③(填序号).
①无色无味液体②有毒③不溶于水④密度比水大⑤任何条件下不与氢气反应⑥可使酸性高锰酸钾溶液和溴水均褪色
写出在浓硫酸作用下,B与浓硝酸反应的化学方程式: .
.
(4)写出由C氧化生成D的化学方程式:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
(5)C与E反应能生成相对分子质量为100的酯,该反应类型为取代反应.
| A | B | C | D | E |
| ①能使溴水褪色 ②比例模型为  ③能与水在一定 条件下反应生 成物质C | ①由C、H两 种元素组成 ②球棍模型为 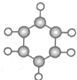 | ①由C、H、O三 种元素组成 ②能与Na反应, 但不能与NaOH 溶液反应 ③能与E反应生成 相对分子质量为 100的酯 | ①相对分子质量 比物质C小2 ②能由物质C氧 化而成 | ①由C、H、O三 种元素组成 ②球棍模型为 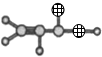 |
(1)A与溴水反应的生成物的名称叫做1,2-二溴乙烷;写出在一定条件下,A生成高分子化合物的化学方程式:
 .
.(2)A与氢气发生加成反应后生成分子F,与F在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2.当n=4时,这类有机物开始出现同分异构体.
(3)B具有的性质是②③(填序号).
①无色无味液体②有毒③不溶于水④密度比水大⑤任何条件下不与氢气反应⑥可使酸性高锰酸钾溶液和溴水均褪色
写出在浓硫酸作用下,B与浓硝酸反应的化学方程式:
 .
.(4)写出由C氧化生成D的化学方程式:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
(5)C与E反应能生成相对分子质量为100的酯,该反应类型为取代反应.
6.已知:某元素X的酸式盐(NaHX)溶液显碱性,下列说法正确的是( )
| A. | NaHX的电离方程式为NaHX═Na++H++X2- | |
| B. | HX-的水解程度大于HX-的电离程度 | |
| C. | 离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HX-)+c(X2-) | |
| D. | 离子浓度关系:c(Na+)>c(HX-)+c(H2X)+c(X2-) |
10.结晶玫瑰是一种有机物,它具有强烈的玫瑰香气,是一种很好的定香剂,下列有可能是结晶玫瑰的分子式的是( )
| A. | C10H9Cl3O2 | B. | C10H9Cl2O2 | C. | C10H12Cl3O2 | D. | C10H17Cl3O2 |