题目内容
主族元素M、R形成的简单离子M2-离子与R+离子的核外电子数之和为20,下列说法正确的是( )
| A、M与R的原子序数之差可能等于7 |
| B、若M在第3周期,则R一定在第2周期 |
| C、M2-的离子半径可能比R+的离子半径小 |
| D、两种离子结合形成的化合物可能是共价化合物 |
考点:原子结构与元素的性质
专题:元素周期律与元素周期表专题
分析:从离子的核外电子数之和为20可推出M、R两种原子的质子数之和为19,则R为Na,M为O,或R为Li,M为S,以此来解答.
解答:
解:A、若M为O,R为Na,M与R的原子序数之差等于3,若R为Li,M为S,则原子序数之差等于13,故A错误;
B、R为Na,M为O,或R为Li,M为S,若M在第3周期为S元素,则R为Li一定在第2周期,故B正确;
C、R为Na,M为O,或R为Li,M为S,半径:Na+<O2-,Li+<S2-,故C错误;
D、由于Na和R或Li和S电负性差别很大,形成的化合物均为离子化合物,故D错误;
故选:B.
B、R为Na,M为O,或R为Li,M为S,若M在第3周期为S元素,则R为Li一定在第2周期,故B正确;
C、R为Na,M为O,或R为Li,M为S,半径:Na+<O2-,Li+<S2-,故C错误;
D、由于Na和R或Li和S电负性差别很大,形成的化合物均为离子化合物,故D错误;
故选:B.
点评:本题考查位置、结构、性质,明确信息得出M、R为何种元素是解答本题的关键,熟悉元素的位置即可解答,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
实验是研究化学的基础,下图中所示的实验方法、装置或操作完全正确的是( )
A、 CCl4萃取碘水的分液操作 |
B、 分离乙醇和乙酸 |
C、 向容量瓶中转移液体 |
D、 配制溶液时定容 |
三氟化氮(NF3)在微电子工业中有重要用途,可由氨气和氟气反应得到:4NH3+3F2=NF3+3NH4F,NF3在潮湿的空气中与水蒸气反应的产物有HF、NO和HNO3.下列说法不正确的是( )
| A、氧化性由弱到强顺序:NH3<NF3<F2 |
| B、生成NF3反应中有0.5mol NH3被氧化,转移电子的数目为1.806×1024 |
| C、NF3在潮湿空气中反应,被氧化与被还原的元素的物质的量之比为2:1 |
| D、若发生NF3泄漏,立即用NaOH或石灰水溶液喷淋的方法可减少污染 |
下列关于Na2O与Na2O2的说法中,错误的是( )
| A、两者颜色不同 |
| B、均可与H2O、CO2反应 |
| C、Na2O能被氧化成Na2O2 |
| D、它们的固体溶于水滴加酚酞试液后,现象相同 |
某溶液中可能含有SO42-、CO32-、Cl-.为了检验其中是否含有SO42-,除BaCl2溶液外,还需要的溶液是( )
| A、稀硫酸 |
| B、稀盐酸 |
| C、NaOH溶液 |
| D、NaNO3溶液 |
如图是在待镀铁制品上镀铜的实验装置,则下列说法正确的是( )


| A、Ⅰ极上铜放电而逐渐消耗 |
| B、电源a极为负极 |
| C、Ⅱ极上发生的电极反应为Fe-2e-═Fe2+ |
| D、Ⅱ极上Cu2+放电而使溶液中Cu2+浓度逐渐变小 |
设阿伏加德罗常数的值为NA,则下列说法不正确的是( )
| A、15g甲基(-CH3)所含有的电子数是9NA |
| B、常温常压下,26g苯乙烯和苯组成的混合物中所含有的原子数为4NA |
| C、常温常压下,1molCnH2n+2所含有的共价键数目为(3n+1)NA |
| D、标准状况下,1L辛烷充分燃烧后生成的气态产物的分子数为8/22.4 NA |
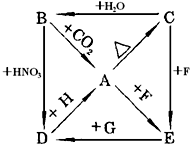 A、B、C、D、E五种物质都是含二价金属元素X的化合物,它们之间存在下列转化关系,图中H,G,F为另加的试剂.根据以上关系回答:
A、B、C、D、E五种物质都是含二价金属元素X的化合物,它们之间存在下列转化关系,图中H,G,F为另加的试剂.根据以上关系回答: ,请回答下列问题.
,请回答下列问题.