题目内容
20.下列关系不正确的是( )| A. | 离子半径:Cl->F->Na+>Al3+ | B. | 非金属性:Cl>S>P>Si | ||
| C. | 酸性:H2SiO3>H2CO3>H3PO4 | D. | 热稳定性:PH3<H2S<HCl<HF |
分析 A.电子层越多,离子半径越大;具有相同电子排布的离子中,原子序数大的离子半径小;
B.同周期从左向右非金属性增强;
C.非金属性越强,最高价含氧酸的酸性越强;
D.非金属性越强,对应氢化物越稳定.
解答 解:A.电子层越多,离子半径越大;具有相同电子排布的离子中,原子序数大的离子半径小,则离子半径:Cl->F->Na+>Al3+,故A正确;
B.同周期从左向右非金属性增强,则非金属性:Cl>S>P>Si,故B正确;
C.非金属性越强,最高价含氧酸的酸性越强,则酸性:H2SiO3<H2CO3<H3PO4,故C错误;
D.非金属性越强,对应氢化物越稳定,则热稳定性:PH3<H2S<HCl<HF,故D正确;
故选C.
点评 本题考查元素周期表和周期律的应用,为高频考点,把握元素的位置、性质、元素周期律等为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案
相关题目
11.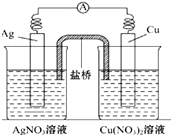 用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U形管)构成一个原电池如图所示.以下有关该原电池的叙述正确的是( )
用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U形管)构成一个原电池如图所示.以下有关该原电池的叙述正确的是( )
 用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U形管)构成一个原电池如图所示.以下有关该原电池的叙述正确的是( )
用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U形管)构成一个原电池如图所示.以下有关该原电池的叙述正确的是( )| A. | 在外电路中,电流由铜电极流向银电极 | |
| B. | 该装置是将电能转化为化学能 | |
| C. | 实验过程中取出盐桥,原电池仍继续工作 | |
| D. | 正极反应为:Ag++e-═Ag |
8.元素周期表是学习化学的重要工具,它隐含着许多信息和规律.如表所列是几种短周期元素的原子半径及主要化合价:
(1)A元素处于周期表中的位置是第三周期第IIA族.
(2)写出D离子的结构示意图 .
.
(3)上述A~F六种元素最高价氧化物对应水化物中酸性最强的是HClO4(填化学式).
(4)C元素气态氢化物的电子式为 .它与C元素最高价氧化物水化物反应的生成物是属于离子(离子或共价)化合物,其中含有的化学键类型有离子键、共价键.
.它与C元素最高价氧化物水化物反应的生成物是属于离子(离子或共价)化合物,其中含有的化学键类型有离子键、共价键.
(5)B的最高价氧化物的水化物与E的最高价氧化物的水化物反应的离子方程式为Al(OH)3+3H+=Al3++3H2O.
(6)元素E与元素F对比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是CD(填选项字母).
A.气态氢化物水溶液的酸性 B.气态氢化物的沸点
C.单质与氢气反应的难易程度 D.气态氢化物的稳定性.
| 元素(或元 素代码) | 铍 | A | B | C | D | E | F |
| 原子半径 (10-10m) | 0.89 | 1.60 | 1.43 | 0.75 | 0.74 | 1.02 | 0.99 |
| 最高价态 | +2 | +2 | +3 | +5 | - | +6 | +7 |
| 最低价态 | - | - | - | -3 | -2 | -2 | -1 |
(2)写出D离子的结构示意图
 .
.(3)上述A~F六种元素最高价氧化物对应水化物中酸性最强的是HClO4(填化学式).
(4)C元素气态氢化物的电子式为
 .它与C元素最高价氧化物水化物反应的生成物是属于离子(离子或共价)化合物,其中含有的化学键类型有离子键、共价键.
.它与C元素最高价氧化物水化物反应的生成物是属于离子(离子或共价)化合物,其中含有的化学键类型有离子键、共价键.(5)B的最高价氧化物的水化物与E的最高价氧化物的水化物反应的离子方程式为Al(OH)3+3H+=Al3++3H2O.
(6)元素E与元素F对比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是CD(填选项字母).
A.气态氢化物水溶液的酸性 B.气态氢化物的沸点
C.单质与氢气反应的难易程度 D.气态氢化物的稳定性.
15.应用元素周期律分析,下列推断正确的是( )
| A. | 第3周期元素最高价氧化物对应的水化物,其碱性随原子序数的增大而减弱 | |
| B. | 砹(At)是第ⅥA族元素,其氢化物的稳定性大于HCl | |
| C. | 第2周期非金属元素的气态氢化物溶于水后,水溶液均为酸性 | |
| D. | 铊(Tl)与铝同主族,Tl(OH)3为两性氢氧化物 |
9.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 0.1mol•L-1 FeCl3溶液:K+、NH${\;}_{4}^{+}$、I-、SCN- | |
| B. | 使甲基橙试液呈红色的溶液:K+、Na+、SO${\;}_{4}^{2-}$、AlO${\;}_{2}^{-}$ | |
| C. | $\frac{{K}_{w}}{c({H}^{+})}$=1×10-13 mol•L-1的溶液中:Al3+、Ca2+、Cl-、NO${\;}_{3}^{-}$ | |
| D. | 水电离产生的c(OH-)=10-12 mol•L-1的溶液:NH${\;}_{4}^{+}$、Mg2+、HCO${\;}_{3}^{-}$、Cl- |
13.下列关于化石燃料的加工说法不正确的是( )
| A. | 石油裂解主要得到乙烯 | |
| B. | 煤干馏主要得到焦炭、煤焦油、粗氨水和焦炉气 | |
| C. | 石蜡油受热分解产生了可以使酸性高锰酸钾溶液褪色的烯烃 | |
| D. | 煤制煤气是物理变化,是高效、清洁地利用煤的重要途径 |