题目内容
1.某研究性学习小组进行电化学实验,研究装置如图所示.有关说法不正确的是( )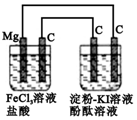
| A. | 电解池中阳极区溶液变红,阴极区溶液变蓝 | |
| B. | 原电池中碳极的电极反应式为:Fe3++e-═Fe2+ | |
| C. | 镁为负极,发生氧化反应 | |
| D. | 电解池中阴极的电极反应式为:2H++e-═H2↑ |
分析 原电池中镁为负极,发生氧化反应,电极方程式为Mg-2e-=Mg2+,正极发生还原反应,电极方程式为Fe3++e-═Fe2+,电解KI溶液时,阳极发生氧化反应,电极方程式为2I--2e-=I2,阴极发生还原反应,电极方程式为2H++2e-═H2↑,以此解答该题.
解答 解:A.电解KI溶液时,阳极生成碘,阴极生成氢气和氢氧化钠,滴加酚酞,所以阳极区溶液变蓝,阴极区溶液变红,故A错误;
B.左边原电池中碳为正极,正极发生还原反应,电极方程式为Fe3++e-═Fe2+,故B正确;
C.原电池中镁为负极,发生氧化反应,故C正确;
D.阴极发生还原反应,电极方程式为2H++2e-═H2↑,故D正确.
故选A.
点评 本题综合考查电解池和原电池知识,为高频考点,侧重于学生的分析能力的考查,注意把握原电池和电解池的工作原理,难度不大.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
4.称取铁粉和氧化铜的混合物6.40g,进行如下实验:

根据实验所得数据,下列说法正确的是( )

根据实验所得数据,下列说法正确的是( )
| A. | 原混合物中铜元素的质量不一定为0.64g | |
| B. | 生成气体体积为2.016L | |
| C. | 实验中反应的硫酸的物质的量为0.1mol | |
| D. | 原混合物中铁的质量分数为78.5% |
12.已知A、B、C、D、E是原子序数依次增大的五种短周期元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料.下列说法正确的是( )
| A. | 工业上常用电解法制备元素C、D、E的单质 | |
| B. | 元素A、B组成的化合物常温下一定呈气态 | |
| C. | 化合物AE与CE含有相同类型的化学键 | |
| D. | 元素B、C、D的最高价氧化物对应的水化物两两之间均可发生化学反应 |
9.下列说法正确的是( )
| A. | 煤中含有苯、甲苯和粗氨水,可通过干馏得到 | |
| B. | 利用油脂在碱性条件的水解,可以制取甘油和高级脂肪酸 | |
| C. | 用溴水可以鉴别:己烯、己烷、四氯化碳三种有机物 | |
| D. | 油脂、纤维素、淀粉和蛋白质都是高分子化合物高*考 |
16.a、b、c、d为原子序数依次增大的短周期主族元素,a与d最外层电子数之和为12,b2-与c+的电子层结构与氖相同,c、d同周期.下列叙述正确的是( )
| A. | a的原子半径是这些元素中最小的 | |
| B. | b与其他三种元素均可形成至少两种二元化合物‘ | |
| C. | c与b形成的二元化合物一定只存在离子键 | |
| D. | d与b、c三种元素形成的化合物的水溶液一定呈碱性 |
6.下列离子方程式书写不正确的是( )
| A. | 向海带灰浸出液中加入硫酸、双氧水:2I-+2H++H2O2═I2+2H2O | |
| B. | 氯气溶于蒸馏水制氯水:Cl2+H2O?H++Cl-+HClO | |
| C. | 向Al2(SO4)3溶液中加入过量的氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | 向沸水中滴加饱和FeCl3制胶体:Fe3++3H2O?Fe (OH)3(胶体)+3H+ |
13.己烯雌酚是一种激素类药物,其结构简式如图所示,下列有关叙述中错误的是( )


| A. | 己烯雌酚的分子式为C18H20O2 | |
| B. | 己烯雌酚分子中所有碳原子一定不在同一平面内 | |
| C. | 己烯雌酚分子可与溴水发生加成反应 | |
| D. | 1 mol己烯雌酚分子与氢气在一定条件下完全反应时,最多可消耗7 mol H2 |
4.以NA表示阿伏加德罗常数,则关于热化学方程式:C2H2(g)+$\frac{5}{2}$O2(g)═2CO2(g)+H2O(l)△H=-1300kJ•mol-1的说法中,正确的是( )
| A. | 当有6 NA个电子转移时,该反应放出1300 kJ的能量 | |
| B. | 当有NA个水分子生成且为液体时,吸收1300 kJ的能量 | |
| C. | 当有4NA个碳氧共用电子对生成时,放出1300 kJ的能量 | |
| D. | 当有8NA个碳氧共用电子对生成时,放出1300 kJ的能量 |
