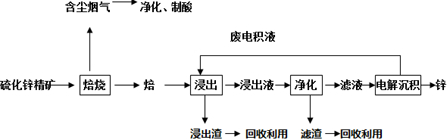
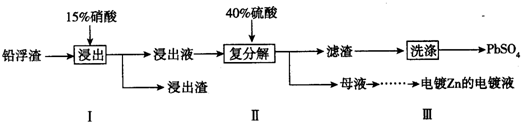
题目内容
14.由短周期元素组成的中学常见物质A、B、C,D、E、X,存在如图转化关系(部分生成物和反应条件略去).下列推断不正确的是( )A$\stackrel{E}{→}$B$\stackrel{B}{→}$C$\stackrel{X}{→}$D.| A. | 若D与盐酸反应,可生成A和B,则X一定是H2O | |
| B. | 若D为NaCl,且A可与C反应生成B,则E 可能是CO2 | |
| C. | 若D是一种强碱,则A、B、C均可与X反应生成D | |
| D. | 若D是一种强酸,则A既可以是单质,也可以是化合物 |
分析 A.FeCl3$\stackrel{Zn}{→}$FeCl2$\stackrel{Zn}{→}$Fe$\stackrel{O_{2}}{→}$Fe3O4;
B.NaOH $\stackrel{CO_{2}}{→}$Na2CO3 $\stackrel{CO_{2}}{→}$NaHCO3$\stackrel{HCl}{→}$NaCl;
C.Na$\stackrel{O_{2}}{→}$Na2O$\stackrel{O_{2}}{→}$Na2O2$\stackrel{H_{2}O}{→}$NaOH;
D.N2(NH3)$\stackrel{O_{2}}{→}$NO$\stackrel{O_{2}}{→}$NO2$\stackrel{H_{2}O}{→}$HNO3.
解答 解:A.符合条件的只有FeCl3$\stackrel{Zn}{→}$FeCl2$\stackrel{Zn}{→}$Fe$\stackrel{O_{2}}{→}$Fe3O4,X不仅可以为H2O,还可为O2,另外Fe不是短周期元素,故A错误;
B.若D为NaCl,且A可与C反应生成B,则E可能是CO2,反应关系为:NaOH $\stackrel{CO_{2}}{→}$Na2CO3 $\stackrel{CO_{2}}{→}$NaHCO3$\stackrel{HCl}{→}$NaCl,故B正确;
C.若D是一种强碱,A可能为Na,反应关系为Na$\stackrel{O_{2}}{→}$Na2O$\stackrel{O_{2}}{→}$Na2O2$\stackrel{H_{2}O}{→}$NaOH,故C正确;
D.若D是一种强酸,则A既可以是单质,也可以是化合物,反应关系为N2(NH3)$\stackrel{O_{2}}{→}$NO$\stackrel{O_{2}}{→}$NO2$\stackrel{H_{2}O}{→}$HNO3,故D正确;
故选A.
点评 本题考查无机物的推断,为高频考点,把握物质的性质、相互转化为解答的关键,侧重分析与推断能力的考查,注意元素化合物知识的综合应用,题目难度不大.

 全能测控期末小状元系列答案
全能测控期末小状元系列答案
(1)步骤一:充分反应后,过滤除去CaSO4沉淀.设计一个简单的实验,检验产物葡萄糖酸溶液中是否含有SO42-:取少量溶液于试管中,滴加BaCl2溶液,若产生白色沉淀,则说明含有SO42-.反之,说明不含SO42-
(2)步骤二:将葡萄糖酸溶液与ZnO混合,使其充分反应后,继续加入葡萄糖酸溶液至pH为5.8,其目的是抑制Zn2+的水解 ,下列物质可替代ZnO的是b(填字母).
a.NH3•H2O b.Zn(OH)2 c.NaOH d.ZnSO4
(3)将最后所得溶液浓缩至原来体积的$\frac{1}{3}$,加入适量无水乙醇,放置8h以上,经结晶、分离、干燥获得葡萄糖酸锌晶体.分离过程中加入无水乙醇的目的是降低葡萄糖酸锌的溶解度,有利于其结晶析出.
(4)下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Cu2+ | 5.2 | 6.4 |
①取样,加入适量的KMnO4溶液,微热,调节溶液pH至3.2~5.2 (填写范围),除去溶液中Fe元素.
②加入过量的锌粉,过滤,向滤渣中加入适量稀硫酸,继续过滤,将两次滤液合并得较高纯度的硫酸锌溶液.
③将纯碱慢慢加入上述硫酸锌溶液中,得碱式碳酸锌[其化学式为Zn2(OH)2CO3],同时有无色气体产生.写出该反应的离子方程式:2CO32-+2Zn2++H2O=Zn2(OH)2CO3↓+CO2↑.
④过滤、洗涤,将沉淀灼烧得活性氧化锌.其中灼烧需要的主要仪器有:酒精灯、玻璃棒、三脚架、泥三角、坩埚、坩埚钳等.
| A. | 木炭在氧气中燃烧,发出白光,放出热量,产生能使澄清石灰水变浑浊的气体 | |
| B. | 细铁丝在空气里剧烈燃烧,火星四射,生成黑色固体物质 | |
| C. | 硫在氧气中燃烧,发出黄色火焰,生成无色有刺激性气味的气体 | |
| D. | 加热铜绿时,生成黑色氧化铜固体 |