题目内容
15.下列溶液中,溶质的物质的量浓度为1mol•L-1的是( )| A. | 将40 g NaOH溶于1 L水所得的溶液 | |
| B. | 将22.4 L HCl溶于水配成1 L溶液 | |
| C. | 1 L含2 mol K+的K2SO4溶液 | |
| D. | 将0.5 mol•L-1的NaNO3溶液100 mL加热蒸发掉50 g 水后的溶液 |
分析 A.体积指溶液体积不是溶剂体积;
B.根据温度、压强对气体摩尔体积的影响分析判断;
C.根据K2SO4的化学式知,溶液中c(K+)=2c(K2SO4),再根据c(K+)=$\frac{n}{V}$计算;
D.根据蒸发掉50g水后溶液体积不是50mL.
解答 解:A.40g氢氧化钠为1mol,体积指溶液体积不是溶剂体积,所以40gNaOH溶解于1L水中配成的NaOH溶液浓度不是1mol/L,故A错误;
B.氯化氢所处的状态不一定是标准状况,不能使用气体摩尔体积22.4L/mol,体积一定,影响气体的物质的量的因素有温度、压强,22.4LHCl气体的物质的量不一定是1mol,故B错误;
C.1 L含K+的物质的量为2 mol的K2SO4溶液中,c(K+)=$\frac{2mol}{1L}$=2mol/L,故c(K2SO4)=2mol/L×$\frac{1}{2}$=1mol/L,故C正确;
D.加热蒸发掉50g水后的溶液体积不是50mL,则溶液浓度不是1mol/L,故D错误;
故选C.
点评 本题考查了物质的量浓度的计算与判断,题目难度中等,明确物质的量浓度的概念及计算方法为解答关键,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
18.下列溶液氯离子的物质的量浓度与1mol•L-1AlCl3溶液中氯离子的物质的量浓度相等的是( )
| A. | 3 mol•L-1氯酸钠溶液 | B. | 3 mol•L-1氯化钙溶液 | ||
| C. | 3 mol•L-1氯化钾溶液 | D. | 3 mol•L-1氯化镁溶液 |
20.用NA代表例伏加德罗常数.下列有关说法,正确的是( )
| A. | 标准状况下,2.24L CCl4 含有的分子数为0.1NA | |
| B. | 500mL lmol•L-1的K2SO4溶液中K+的物质的量为2mol | |
| C. | 25℃,101KPa 下,11.2L CO2中所含氧原子个数小于NA | |
| D. | 2.7gAl与足量稀盐酸反应,转移0.2NA个电子 |
7.20g A物质和14g B物质恰好完全反应,生成8.8g C物质、3.6g D物质和标准状况下4.48L气体E,则E物质的摩尔质量为( )
| A. | 100g/mol | B. | 108g/mol | C. | 55g/mol | D. | 96g/mol |
4.工业上常用氯氧化法处理含氰(CN-)废水,反应原理为液氯在碱性条件下可以先将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一):KCN+2KOH+Cl2=KOCN+2KCl+H2O;氰酸盐再进一步被液氯氧化为无毒气体.下列说法不正确的是( )
| A. | KCN 与KOCN中氮元素的化合价均为-3价 | |
| B. | 氰酸盐被氧化过程中氮和碳的化合价均升高 | |
| C. | 氰酸盐进一步被氧化的产物之一是无毒的N2 | |
| D. | 完全处理含0.1 mol CN-的废水,理论上需要消耗Cl2的体积为5.6L(标准状况下) |
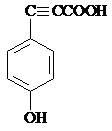 .
.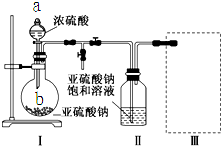 焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一.某研究小组进行如下实验:
焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一.某研究小组进行如下实验: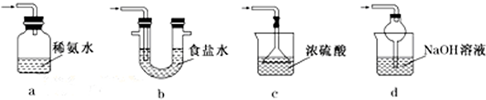

 替代,请将Br2与Na2CO3反应的化学方程式补充完整
替代,请将Br2与Na2CO3反应的化学方程式补充完整