题目内容
3.图为反应2H2(g)+O2(g)=2H2O(g)的能量变化示意图.下列说法正确的是( )
| A. | 拆开2molH2(g)和1 molO2 (g)中的化学键成为H、O原子,共放出1368 kJ能量 | |
| B. | 由H、O原子形成2 molH2O(g),共吸收1852 kJ能量 | |
| C. | 2 molH2(g)和1 molO2(g)反应生成2 molH2O(1),共吸收484 kJ能量 | |
| D. | 2 molH2(g)和1 molO2 (g)反应生成2 moIH2O(g),共放出484 kJ能量 |
分析 A.拆化学键吸收能量;
B.形成化学键放出能量;
C.依据反应焓变=反应物化学键键能总和-生成物化学键键能总和计算分析;
D.依据反应焓变=反应物化学键键能总和-生成物化学键理念总和;
解答 解:A.拆化学键吸收能量,故A错误;
B.形成化学键放出能量,故B错误;
C.依据图象数据分析计算,2 mol H2(g)和1 mol O2(g)反应生成2 mol H2O(g),共放出484 kJ能量,故C错误;
D.依据图象数据分析计算,2 mol H2(g)和1 mol O2(g)反应生成2 mol H2O(g),共放出484 kJ能量,故D正确;
故选D.
点评 本题考查了反应能量变化,图象分析数据计算应用,注意反应焓变=反应物化学键键能总和-生成物化学键键能总和,题目难度中等.

练习册系列答案
相关题目
14.足量的Fe粉与一定量的盐酸反应,反应速率太快,为了加快反应速率,但又不影响产生氢气的总量,应加入下列物质中的( )
| A. | 水 | B. | NaNO3溶液 | C. | NaCl溶液 | D. | CuSO4粉末 |
11.已知A、B、C、D、E是元素周期表中同一周期的五种元素,A和B的最高价氧化物对应水化物显碱性,且碱性B>A,C和D的气态氢化物的水溶液显酸性,且酸性C>D;五种元素所形成的简单离子中,E的离子半径最小,则它们的原子序数由小到大的顺序是( )
| A. | CDEAB | B. | ECDAB | C. | BAEDC | D. | BADCE |
18.下列有机物分子中可形成顺反异构的是( )
| A. | CH3CH=CHBr | B. | CH3-Cl | C. | CH3CH=CH2 | D. | CH3CH=C(CH3)2 |
8.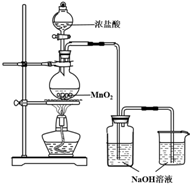 某实验小组用如图装置制备家用消毒液,并探究其性质.
某实验小组用如图装置制备家用消毒液,并探究其性质.
(1)写出装有浓盐酸的仪器名称分液漏斗,A中烧瓶内进行的反应中浓盐酸体现出的化学性质是酸性和还原性
(2)写出装置B中发生的所有反应化学方程式Cl2+2NaOH=NaCl+NaClO+H2O、HCl+NaOH=NaCl+H2O
(3)装置c的作用是吸收多余氯气,避免污染空气
反应停止后,各取洗气瓶中无色溶液5mL分别进行了如下实验:
(4)查阅资料:酚酞的变色范围为8.2~10,且酚酞在强碱性溶液中红色会褪去
为探究操作A中溶液褪色的原因,又补充了如下实验:
获得结论:此实验小组制备的消毒液具有漂白性.
(5)操作B中溶液变成黄绿色的原因:2H++ClO-+Cl-═Cl2↑+H2O(用离子方程式表示).
 某实验小组用如图装置制备家用消毒液,并探究其性质.
某实验小组用如图装置制备家用消毒液,并探究其性质.(1)写出装有浓盐酸的仪器名称分液漏斗,A中烧瓶内进行的反应中浓盐酸体现出的化学性质是酸性和还原性
(2)写出装置B中发生的所有反应化学方程式Cl2+2NaOH=NaCl+NaClO+H2O、HCl+NaOH=NaCl+H2O
(3)装置c的作用是吸收多余氯气,避免污染空气
反应停止后,各取洗气瓶中无色溶液5mL分别进行了如下实验:
| 操作 | 现象 |
| A.测溶液pH,并向其中滴加2滴酚酞 | pH=13,溶液变红,5min后褪色 |
| B. 向其中逐滴加入盐酸 | 溶液逐渐变成黄绿色 |
为探究操作A中溶液褪色的原因,又补充了如下实验:
| 操作 | 现象 |
| 取5ml,pH=13NaOH溶液,向其中滴加2滴酚酞 | 溶液变红,30min后褪色 |
(5)操作B中溶液变成黄绿色的原因:2H++ClO-+Cl-═Cl2↑+H2O(用离子方程式表示).
15.己知碘(I)元素有-1、+l、+3、+5、+7等多种化合价,有些碘的氧化物可以看成是由带正电荷的碘离子和碘酸根离子(IO3-)构成.下列的化学式是碘酸碘的是( )
| A. | I2O5 | B. | I2O4 | C. | I4O5 | D. | I4O9 |


 +NaHCO3→
+NaHCO3→ +CO2↑+H2O.
+CO2↑+H2O.