题目内容
t℃时,水的离子积为Kw,该温度下将a mol?L-1 一元酸HA与b mol?L-1 一元碱BOH等体积混合,混合液一定呈中性的是( )
| A、混合液的pH=7 |
| B、混合液中c(B+)=c(A-) |
| C、a=b |
| D、加入甲基橙显橙色 |
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:Kw=c(H+)?c(OH-),该温度下将amol/L一元酸HA与bmol/L一元碱BOH等体积混合,若混合后溶液呈中性,则c(H+)=c(OH-),根据电荷守恒可知:c(B+)=c(A-);由于温度不确定,则中性时溶液pH不一定为7;由于酸碱的强弱未知,则不能确定a、b的关系;甲基橙的变色范围为3.1-4.4,甲基橙显示橙色是,溶液的pH介于3.1-4.4之间,溶液显示酸性,据此进行判断.
解答:
解:A.温度不确定,则中性时溶液pH不一定为7,故A错误;
B.根据电荷守恒c(B+)+c(H+)=c(A-)+c(OH-)可知,c(B+)=c(A-),则c(H+)=c(OH-),溶液一定显示中性,故B正确;
C.由于酸碱的电解质强弱未知,无法确定a、b的大小关系,故C错误;
D.甲基橙显示橙色,则溶液的pH介于3.1-4.4之间,溶液显示酸性,故D错误;
故选B.
B.根据电荷守恒c(B+)+c(H+)=c(A-)+c(OH-)可知,c(B+)=c(A-),则c(H+)=c(OH-),溶液一定显示中性,故B正确;
C.由于酸碱的电解质强弱未知,无法确定a、b的大小关系,故C错误;
D.甲基橙显示橙色,则溶液的pH介于3.1-4.4之间,溶液显示酸性,故D错误;
故选B.
点评:本题考查了酸碱混合的定性判断、溶液酸碱性与溶液pH的关系,题目难度中等,注意掌握水的电离及其影响因素,明确判断酸碱混合的定性判断方法,选项A为易错点,注意温度影响水的电离,不能直接根据溶液的pH判断溶液的酸碱性.

练习册系列答案
相关题目
关于CF2Cl2(氟里昂-12)的叙述正确的是( )
| A、有两种同分异构体 |
| B、是平面型分子 |
| C、只有一种结构 |
| D、键角是90° |
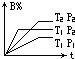 反应aA(g)+bB(g)?cC(g)△H=Q kJ/mol在不同温度(T1、T2)和不同压强(P1、P2)下,B的百分含量(B%)与时间的关系如图,则下列说法正确的是( )
反应aA(g)+bB(g)?cC(g)△H=Q kJ/mol在不同温度(T1、T2)和不同压强(P1、P2)下,B的百分含量(B%)与时间的关系如图,则下列说法正确的是( )| A、a+b<c,Q>0 |
| B、a+b>c,Q>0 |
| C、a+b<c,Q<0 |
| D、a+b>c,Q<0 |
某一元醇C3H8O中氧为18O,它与乙酸反应生成的酯的相对分子质量为( )
| A、100 | B、102 |
| C、104 | D、106 |
下列叙述正确的是( )
| A、1molO2的质量为32g/mol |
| B、1mol物质的质量等于该物质的式量 |
| C、SO42-的摩尔质量为96g/mol |
| D、CO2的摩尔质量为44g |
物质的量浓度相同的下列溶液中,符合按pH由小到大顺序排列的是( )
| A、HCl NH4Cl CH3COOH NaNO3 Na2CO3 NaHCO3 NaOH |
| B、HCl NH4Cl CH3COOH NaHCO3 NaNO3 Na2CO3 NaOH |
| C、HCl CH3COOH NH4Cl NaNO3 NaHCO3 Na2CO3 NaOH |
| D、HCl CH3COOH NH4Cl NaNO3 Na2CO3 NaHCO3 NaOH |
 的烃跟D2以等物质的量混合,并在一定条件下反应,所得产物的结构简式可能是(其中加重氢原子的碳原子均为*号标记)( )
的烃跟D2以等物质的量混合,并在一定条件下反应,所得产物的结构简式可能是(其中加重氢原子的碳原子均为*号标记)( )



 某化学学习小组为研究HA、HB和MOH的酸碱性的相对强弱,设计以下实验:将pH=2的两种酸溶液HA、HB和pH=12的MOH碱溶液各1mL,分别加水稀释到1000mL,其pH的变化与溶液体积的关系如图,根据所给的数据,请回答下列问题:
某化学学习小组为研究HA、HB和MOH的酸碱性的相对强弱,设计以下实验:将pH=2的两种酸溶液HA、HB和pH=12的MOH碱溶液各1mL,分别加水稀释到1000mL,其pH的变化与溶液体积的关系如图,根据所给的数据,请回答下列问题: