题目内容
下列解释事实的化学方程式或离子方程式不正确的是( )
| A、向饱和Na2CO3中加入过量CO2气体:CO32-+CO2+H2O=2HCO3- |
| B、在沸水中滴入饱和FeCl3溶液制取Fe(OH)3胶体:Fe3++3H2O=Fe(OH)3(胶体)+3H+ |
| C、4mol/L的NaAlO2溶液和7mol/L的盐酸等体积混合:4AlO2-+7H++H2O=3Al(OH)3↓+Al3+ |
| D、酸化的KMnO4溶液与H2O2反应:2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O |
考点:离子方程式的书写
专题:离子反应专题
分析:A.碳酸氢钠溶解性小于碳酸钠,二者反应生成碳酸氢钠导致溶液为过饱和溶液,有碳酸氢钠沉淀生成;
B.铁离子水解生成氢氧化铁胶体,同时生成HCl;
C.4mol/L的NaAlO2溶液和7mol/L的盐酸等体积混合,NaAlO2溶液和盐酸的物质的量之比为4:7,所以有氢氧化铝和氯化铝生成;
D.酸性条件下,高锰酸钾具有强氧化性,能将双氧水氧化生成氧气,自身被还原生成锰离子.
B.铁离子水解生成氢氧化铁胶体,同时生成HCl;
C.4mol/L的NaAlO2溶液和7mol/L的盐酸等体积混合,NaAlO2溶液和盐酸的物质的量之比为4:7,所以有氢氧化铝和氯化铝生成;
D.酸性条件下,高锰酸钾具有强氧化性,能将双氧水氧化生成氧气,自身被还原生成锰离子.
解答:
解:A.碳酸氢钠溶解性小于碳酸钠,二者反应生成碳酸氢钠导致溶液为过饱和溶液,有碳酸氢钠沉淀生成,离子方程式为2Na++CO32-+CO2+H2O=2NaHCO3↓,故A错误;
B.铁离子水解生成氢氧化铁胶体,同时生成HCl,离子方程式为Fe3++3H2O=Fe(OH)3(胶体)+3H+,故B正确;
C.4mol/L的NaAlO2溶液和7mol/L的盐酸等体积混合,NaAlO2溶液和盐酸的物质的量之比为4:7,偏铝酸钠和相同物质的量的盐酸反应生成氢氧化铝,剩余的HCl和氢氧化铝反应生成氯化铝,且氢氧化铝和氯化铝的物质的量之比为2:1,所以有氢氧化铝和氯化铝生成,离子方程式为4AlO2-+7H++H2O=3Al(OH)3↓+Al3+,故C正确;
D.酸性条件下,高锰酸钾具有强氧化性,能将双氧水氧化生成氧气,自身被还原生成锰离子,离子方程式为2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O,故D正确;
故选A.
B.铁离子水解生成氢氧化铁胶体,同时生成HCl,离子方程式为Fe3++3H2O=Fe(OH)3(胶体)+3H+,故B正确;
C.4mol/L的NaAlO2溶液和7mol/L的盐酸等体积混合,NaAlO2溶液和盐酸的物质的量之比为4:7,偏铝酸钠和相同物质的量的盐酸反应生成氢氧化铝,剩余的HCl和氢氧化铝反应生成氯化铝,且氢氧化铝和氯化铝的物质的量之比为2:1,所以有氢氧化铝和氯化铝生成,离子方程式为4AlO2-+7H++H2O=3Al(OH)3↓+Al3+,故C正确;
D.酸性条件下,高锰酸钾具有强氧化性,能将双氧水氧化生成氧气,自身被还原生成锰离子,离子方程式为2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O,故D正确;
故选A.
点评:本题考查离子方程式正误判断,明确物质的性质及离子之间的反应是解本题关键,易错选项是A,注意碳酸氢钠和碳酸钠溶解性大小,难点是C选项,要注意物质之间量的关系,题目难度中等.

练习册系列答案
相关题目
主链上有6个碳原子,含甲基、乙基两个支链的烷烃有( )
| A、2种 | B、4种 | C、8种 | D、12种 |
在水溶液中能大量共存的一组离子是( )
| A、HCO3-、H+、NO3-、Na+ |
| B、Na+、Cu2+、OH-、SO42- |
| C、Mg2+、H+、OH-、SO42- |
| D、NH4+、K+、Br-、NO3- |
NA代表阿伏加德罗常数的数值,下列说法正确的是( )
| A、1molCl2参加的任何反应,反应过程中转移电子数都是2NA |
| B、标准状况下,11.2L乙醇所含的羟基数为0.5NA |
| C、常温常压下,17g甲基(-14CH3)所含的中子数为9NA |
| D、室温下,42.0 g乙烯和丙烯的混合气体中含有的碳原子数约为3×6.02×1023个 |
已知:2CO (g)+O2 (g)═2CO2 (g);△H1=-566kJ?mol-1 Na2O2(s)+CO2(g)=Na2CO3(g)+O2(g);△H2=-226kJ?mol-1 根据以上热化学方程式判断,下列说法正确的是( )
| A、CO的燃烧热为283kJ |
| B、2Na2O2(s)+2CO2(s)=2Na2CO3(g)+2O2(g);△H3>-452kJ?mol-1 |
C、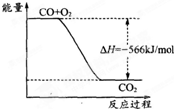 如图可表示由CO生成CO2的反应过程和能量关系 |
| D、CO(g)与Na2O2 (s)反应放出509kJ热量时,电子转移数约为6.02×1023 |