题目内容
常温下,下列指定条件下能大量共存的微粒是( )
| A、乙醇稀溶液:K+、Na+、SO42-、OH- | ||
| B、氨水溶液:Mg2+、Ag+、NO3-、CH3COOH | ||
C、
| ||
| D、使石蕊变红的溶液:Fe2+、Al3+、ClO-、CO32- |
考点:离子共存问题
专题:离子反应专题
分析:A.K+、Na+、SO42-、OH-离子之间不发生反应,也不与乙醇反应;
B.氨水能够与镁离子、银离子发生反应;
C.该溶液为碱性溶液,氯化氢、钙离子、碳酸氢根离子能够与氢氧根离子反应;
D.该溶液为酸性溶液,次氯酸根离子能够与亚铁离子、氢离子反应,亚铁离子、铝离子能够与碳酸根离子反应.
B.氨水能够与镁离子、银离子发生反应;
C.该溶液为碱性溶液,氯化氢、钙离子、碳酸氢根离子能够与氢氧根离子反应;
D.该溶液为酸性溶液,次氯酸根离子能够与亚铁离子、氢离子反应,亚铁离子、铝离子能够与碳酸根离子反应.
解答:
解:A.K+、Na+、SO42-、OH-之间不反应,且都不与乙醇反应,在溶液中能够大量共存,故A正确;
B.:Mg2+、Ag+、CH3COOH能够与氨水反应,在溶液中不能大量共存,故B错误;
C.该溶液为碱性溶液,H2S、Ca2+、HCO3-能够与氢氧根离子反应,在溶液中不能大量共存,故C错误;
D.该溶液为酸性溶液,ClO-、CO32-能够与氢离子反应,Fe2+、Al3+能够与CO32-发生反应,在溶液中不能大量共存,故D错误;
故选A.
B.:Mg2+、Ag+、CH3COOH能够与氨水反应,在溶液中不能大量共存,故B错误;
C.该溶液为碱性溶液,H2S、Ca2+、HCO3-能够与氢氧根离子反应,在溶液中不能大量共存,故C错误;
D.该溶液为酸性溶液,ClO-、CO32-能够与氢离子反应,Fe2+、Al3+能够与CO32-发生反应,在溶液中不能大量共存,故D错误;
故选A.
点评:本题考查了离子方程的判断,题目难度中等,注意掌握离子反应发生条件,明确常见的离子不能共存的情况,特别需要注意题干暗含条件,试题培养了学生灵活应用所学知识的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
分子式为C9H12O,苯环上有两个取代基且含羟基的化合物,其可能的结构有( )
| A、9种 | B、12种 |
| C、15种 | D、16种 |
将a mol氢气和b mol乙烯混合,在一定条件下使它们部分反应生成c mol乙烷,将反应后的混合气体完全燃烧,消耗氧气的物质的量为( )
| A、(3b+0.5a)mol |
| B、(4b+0.5a)mol |
| C、(3b+1.5a)mol |
| D、无法判断 |
通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀.阳离子E是( )
| A、可能是Al3+,也可能是Mg2+ |
| B、只能是Al3+ |
| C、只能是Mg2+ |
| D、以上说法都不对 |
下列离子方程式中正确的是( )
| A、Cl2通入水中:Cl2+H2O?2H++Cl-+C1O- | ||||
| B、钢铁发生吸氧腐蚀时,铁作负极:Fe-3e-=Fe3+ | ||||
| C、向双氧水中加入稀硫酸和KI溶液:H2O2+2H++2I-=I2+2H2O | ||||
D、用铜作阳极电解CuSO4溶液:2Cu2++2H2O
|
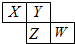 如图所示是元素周期表的一部分,X、Y、Z、W均为短周期元素,若w原子最外层电子数是其内层电子数的
如图所示是元素周期表的一部分,X、Y、Z、W均为短周期元素,若w原子最外层电子数是其内层电子数的| 7 |
| 10 |
| A、XY2和ZY2都是造成酸雨的主要因素 |
| B、Y元素的两种同素异形体在常温下都是气体 |
| C、最高价氧化物对应水化物的酸性W>Z |
| D、氢化物的沸点:HnZ 高于HnY |
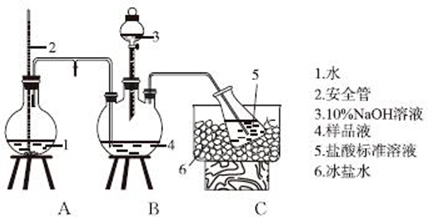

 某地区使用含较多Ca2+、Mg2+的天然水按下列步骤制取纯净水.
某地区使用含较多Ca2+、Mg2+的天然水按下列步骤制取纯净水.