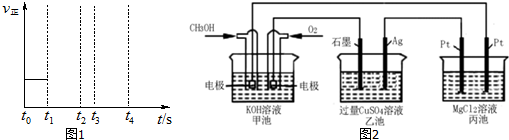
题目内容
3.关于某溶液中所含离子的检验,下列判断正确的是( )| A. | 加入BaCl2溶液,生成白色沉淀,加稀硝酸沉淀不消失,则原溶液中一定含SO42- | |
| B. | 用洁净的铂丝蘸取溶液在火焰上灼烧,产生黄色的火焰,则原溶液中一定不含K+ | |
| C. | 向某溶液中加入2滴KSCN溶液,溶液不显红色,再向溶液中滴几滴新制的氯水,溶液变为红色,该溶液中一定含有Fe2+ | |
| D. | 加盐酸,生成的气体能使澄清石灰水变浑浊,则原溶液中一定含有CO32- |
分析 A、不能排除SO32-和Ag+的干扰;
B、钾元素的紫色必须透过蓝色钴玻璃来观察;
C、根据Fe2+不与KSCN反应的性质分析;
D、产生能使澄清石灰水变浑浊的无色气体,可能为CO32-、HCO3-或SO32-.
解答 解:A、SO32-能被硝酸氧化为SO42-,并且不能排除Ag+的干扰,故A错误;
B、钾元素的紫色必须透过蓝色钴玻璃来观察,故如果不透过蓝色钴玻璃,无法确定是否含有钾元素,故B错误;
C、溶液不显红色,说明不含Fe3+,再向溶液中滴几滴新制的氯水,溶液变为红色,说明含有Fe2+,故C正确;
D.产生能使澄清石灰水变浑浊的无色气体,可能为CO32-、HCO3-或SO32-,故D错误.
故选C.
点评 本题考查离子的检验,题目难度不大,注意把握相关离子的性质,检验时要考虑排除其它离子的干扰.

练习册系列答案
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案
相关题目
14.已知298K,1.01×105Pa条件下:2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ•mol-1;CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-282.9kJ•mol-1则该条件下CO(g)+H2O(g)═H2(g)+CO2(g)的反应热是( )
| A. | -41.1 kJ•mol-1 | B. | +200.7 kJ•mol-1 | C. | -766.5 kJ•mol-1 | D. | +41.1 kJ•mol-1 |
11.酸雨、臭氧层被破坏、温室效应和土地荒漠化是当今人类面临的严重环境问题.下列说法中错误的是( )
| A. | 在冰箱中使用含氟致冷剂,会破坏臭氧层 | |
| B. | 大量使用矿物燃料会导致温室效应 | |
| C. | 大量含硫燃料的燃烧会导致酸雨的增多 | |
| D. | 气侯变暖是导致土地荒漠化的主要原因 |
18.用酸性氢氧燃料电池为电源进行电解的实验装置示意图如图所示.下列说法中,正确的是( )
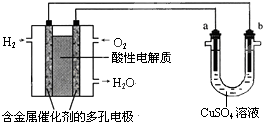

| A. | 燃料电池工作时,正极反应为:O2+4H+-4e-═2H2O | |
| B. | a极是粗铜,b极是纯铜,CuSO4溶液作电解质溶液时,CuSO4溶液浓度保持不变 | |
| C. | a、b两极均是石墨,CuSO4溶液作电解质溶液时,在相同条件下a极产生的气体与电池中消耗的H2体积相等 | |
| D. | a极是铜,b极是铁,NaCl溶液作电解质溶液时铁受到保护,腐蚀速率减慢 |
8.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 23gNO2和23gN2O4所含原子数目均为1.5NA | |
| B. | 5.6 g铁与足量盐酸反应转移的电子数为0.3NA | |
| C. | 在常温常压下11.2L氯气所含的原子数目为NA | |
| D. | 高温下,0.2molFe与足量水蒸气反应,生成的H2分子数目为0.3NA |
15.15g SiO2和足量的碳在高温下发生反应:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,下列叙述正确的是( )
| A. | 氧化剂和还原剂的质量比1:2 | B. | SiO2是还原剂 | ||
| C. | 反应中有6g碳被氧化 | D. | 反应中生成28gCO |
12.在无色透明强酸性溶液中,能大量共存的离子组是( )
| A. | K+、MnO4-、Mg2+、SO42- | B. | K+、Na+、Cl-、CO32- | ||
| C. | Zn2+、Al3+、NO3-、Cl- | D. | Na+、Fe2+、NO3-、SO42- |
13.向含有下列各离子组的溶液中通入足量相应气体后,各离子还能大量存在的是( )
| A. | 二氧化碳:K+、Na+、SiO32-、Cl- | B. | 氨气:Ag+、Al3+、Na+、NO3- | ||
| C. | 氯化氢:Ca2+、Fe3+、NO3-、Cl- | D. | 氯气:Na+、Ba2+、I-、HSO3- |