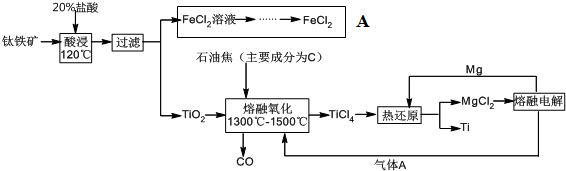
题目内容
18.用酸性氢氧燃料电池为电源进行电解的实验装置示意图如图所示.下列说法中,正确的是( )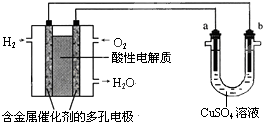
| A. | 燃料电池工作时,正极反应为:O2+4H+-4e-═2H2O | |
| B. | a极是粗铜,b极是纯铜,CuSO4溶液作电解质溶液时,CuSO4溶液浓度保持不变 | |
| C. | a、b两极均是石墨,CuSO4溶液作电解质溶液时,在相同条件下a极产生的气体与电池中消耗的H2体积相等 | |
| D. | a极是铜,b极是铁,NaCl溶液作电解质溶液时铁受到保护,腐蚀速率减慢 |
分析 左边装置是氢氧燃料电池,原电池放电时,燃料失电子发生氧化反应,所以投放燃料的电极为负极,投放氧化剂的电极为正极,正极上氧气得电子生成水,正极反应为:O2+4e-+4H+=2H2O;右边装置有外接电源,所以是电解池,连接负极的b电极是阴极,连接正极的a电极是阳极,阳极上失电子发生氧化反应,阴极上得电子发生还原反应,结合电解反应解答.
解答 解:A.因该燃料电池是在酸性电解质中工作,正极上氧气得电子生成水,所以正极反应为:O2+4e-+4H+=2H2O,故A错误;
B.a极是粗铜,b极是纯铜,CuSO4溶液作电解质溶液时,a极上Cu及铜中活泼性较强的金属失电子形成阳离子,而b极上只析出Cu,所以CuSO4溶液浓度减小,故B错误;
C.电解CuSO4溶液时,a极产生的气体为O2,产生1molO2需4mol电子,所以需要燃料电池的2molH2,二者的体积并不相等,故C错误;
D.a极是铜,b极是铁,NaCl溶液作电解质溶液时,Fe与负极相连作阴极,阴极上溶液中的阳离子反应,而Fe不反应,所以铁受到保护,腐蚀速率减慢,故D正确;
故选D.
点评 本题考查原电池和电解池知识,题目难度中等,注意电极的判断和电极方程式的书写,明确电解质的酸碱性对电极反应的影响是解题的关键,侧重于考查学生的分析能力.

练习册系列答案
相关题目
9.用一种试剂把Na2CO3、NaCl、AlCl3、NH4NO3四种溶液区分开,这种试剂是( )
| A. | Ba(OH)2 溶液 | B. | NaOH溶液 | C. | BaCl2溶液 | D. | AgNO3溶液 |
13.下列说法或表示法错误的是( )
| A. | 吸热反应是由于反应物的总能量比生成物的总能量低 | |
| B. | 放热反应的△H>0 | |
| C. | 需要加热才能发生反应不一定是吸热反应 | |
| D. | 酸碱中和反应都是放热反应 |
3.关于某溶液中所含离子的检验,下列判断正确的是( )
| A. | 加入BaCl2溶液,生成白色沉淀,加稀硝酸沉淀不消失,则原溶液中一定含SO42- | |
| B. | 用洁净的铂丝蘸取溶液在火焰上灼烧,产生黄色的火焰,则原溶液中一定不含K+ | |
| C. | 向某溶液中加入2滴KSCN溶液,溶液不显红色,再向溶液中滴几滴新制的氯水,溶液变为红色,该溶液中一定含有Fe2+ | |
| D. | 加盐酸,生成的气体能使澄清石灰水变浑浊,则原溶液中一定含有CO32- |
10.只含SiO2杂质的CaCO3样品,在高温煅烧后,残余物为一纯净物,则原样品中SiO2的质量分数是( )
| A. | 40% | B. | 28.6% | C. | 37.5% | D. | 62.5% |
7.下列物质的主要成分和光导纤维的成分不同的是( )
| A. | 水晶 | B. | 玛瑙 | C. | 石英 | D. | 计算机芯片 |
8. 某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z和W,它们的物质的量随时间的变化如下表所示.
某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z和W,它们的物质的量随时间的变化如下表所示.
(1)体系中发生反应的化学方程式是2X+2Y?2Z+W;
(2)列式计算该反应在0~3min时间内产物W的平均反应速率:0.042 mol/(L•min);
(3)该反应达到平衡时反应物Y的转化率α等于90%;
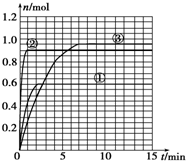
(4)如果该反应是放热反应.改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线①、②、③(如图所示)则曲线①、②、③所对应改变的实验条件分别是:①升高温度;②加入催化剂;③增大压强.
 某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z和W,它们的物质的量随时间的变化如下表所示.
某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z和W,它们的物质的量随时间的变化如下表所示.| t/min | X/mol | Y/mol | Z/mol | W/mol |
| 0 | 2.00 | 1.00 | 0.00 | 0.00 |
| 1 | 1.80 | 0.80 | 0.20 | 0.10 |
| 3 | 1.50 | 0.50 | 0.50 | 0.25 |
| 5 | 1.30 | 0.30 | 0.70 | 0.35 |
| 9 | 1.10 | 0.10 | 0.90 | 0.45 |
| 10 | 1.10 | 0.10 | 0.90 | 0.45 |
| 14 | 1.10 | 0.10 | 0.90 | 0.45 |
(2)列式计算该反应在0~3min时间内产物W的平均反应速率:0.042 mol/(L•min);
(3)该反应达到平衡时反应物Y的转化率α等于90%;
(4)如果该反应是放热反应.改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线①、②、③(如图所示)则曲线①、②、③所对应改变的实验条件分别是:①升高温度;②加入催化剂;③增大压强.