��Ŀ����
2������˵������ȷ���ǣ���������������ʹ��Ƶ�ʺܸߵ�һԪֽ�ҽ���Ӳ�������Ӳ���ǺϽ�
�ڽ����뺣���������γ�ͨ���뽺��������й�
�ۡ����͡���ʹ�õ����ᱵ���������
��̫���ܵ�ذ��еĹ���Ԫ�����ڱ��д��ڽ�����ǽ����Ľ���λ��
�ݳ��õ�����ˮ��������������H2O2�����߶����м��Լ�
��ˮ½���ù��������У������ܷ�������Ǹ߷��ӻ����
| A�� | �٢ڢۢ� | B�� | �٢ڢܢ� | C�� | �٢ڢݢ� | D�� | �ۢܢݢ� |
���� �ٺϽ������ֻ���ֻ�ѧ��ֹ��ɵĹ����������ʽ�IJ��ϻ����ʣ�
�ڽ����뺣���������γ������ڽ���ľ۳���
�����ᱵ������״̬������ȫ����������ƶ������ӣ�
�ܹ���Ԫ�����ڱ��д��ڽ�����ǽ����Ľ���λ�ã�
�����ֲ�ͬԪ��֮���γɵĻ�ѧ���Ǽ��Լ���
�����Ǹ߷��ӻ����
��� �⣺�ٺϽ������ֻ���ֻ�ѧ��ֹ��ɵĹ����������ʽ�IJ��ϻ����ʣ�Ӳ���ǺϽ𣬹���ȷ��
����ɳ����������ˮ�еĵ���ʷ����˾۳����ջ����ۣ��γ��������ޣ�����ȷ��
�ۡ����͡������ᱵ�������ᱵ��ǿ����ʣ���Ϊ�������ᱵ�������ﵫ����ˮ�IJ���ȷʵ��ȫ����ģ��ʴ���
�ܹ���Ԫ�����ڱ��д��ڽ�����ǽ����Ľ���λ�ã����ڰ뵼����ϣ�����̫���ܵ�ذ��У�����ȷ��
��������H2O2��ǰ�߲������Լ������Ǻ��ߺ��У��ʴ���
�����Ǹ߷��ӻ�����ʢ���ȷ��
��ѡB��
���� ���⿼�����ݽ϶࣬�漰���塢���͡�����ɺͳɷ֣���ѧ����ǿ������ʵ������֪ʶ�㣬�Ƚϻ��������ضԻ���֪ʶ�Ĺ��̣�ע��Ի���֪ʶ����������

��ϰ��ϵ�д�
 Ʒѧ˫�ž�ϵ�д�
Ʒѧ˫�ž�ϵ�д� Сѧ��ĩ���100��ϵ�д�
Сѧ��ĩ���100��ϵ�д� ��ĩ��ϰ���ϵ�д�
��ĩ��ϰ���ϵ�д� ����ѧ�䵥Ԫ������ĩר����100��ϵ�д�
����ѧ�䵥Ԫ������ĩר����100��ϵ�д� �Ƹ�360�ȶ����ܾ�ϵ�д�
�Ƹ�360�ȶ����ܾ�ϵ�д�
�����Ŀ
12�����й���ҩ���������ȷ���ǣ�������
| A�� | �ڷ�ǰ��������ͣ�����������������ҩ�����Ч�ɷ� | |
| B�� | ��������ȡ�ȷ������в�ҩ����ȡ��Ч�ɷ� | |
| C�� | ����θ����Ļ��߿���С�մ�����θ����� | |
| D�� | ������Ĥ��װ��ҩƷ������û���κ�Σ�� |
13������Ԫ���У�ԭ��M���������K������ͬ���У�������
| A�� | F | B�� | Mg | C�� | Al | D�� | Si |
10���������ƣ�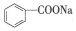 ����дΪNaA�����������ϵķ��������о����������ᣨHA�����־�������������A-����֪25��ʱ��HA��Ka=6.25��10-5��H2CO3��Ka1=4.17��10-7��Ka2=4.90��10-11��������̼�����ϵĹ����У���������NaA�⣬�����ѹ����CO2���壮����˵����ȷ���ǣ��¶�Ϊ25�棬�����������������ɷ֣���������
����дΪNaA�����������ϵķ��������о����������ᣨHA�����־�������������A-����֪25��ʱ��HA��Ka=6.25��10-5��H2CO3��Ka1=4.17��10-7��Ka2=4.90��10-11��������̼�����ϵĹ����У���������NaA�⣬�����ѹ����CO2���壮����˵����ȷ���ǣ��¶�Ϊ25�棬�����������������ɷ֣���������
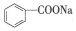 ����дΪNaA�����������ϵķ��������о����������ᣨHA�����־�������������A-����֪25��ʱ��HA��Ka=6.25��10-5��H2CO3��Ka1=4.17��10-7��Ka2=4.90��10-11��������̼�����ϵĹ����У���������NaA�⣬�����ѹ����CO2���壮����˵����ȷ���ǣ��¶�Ϊ25�棬�����������������ɷ֣���������
����дΪNaA�����������ϵķ��������о����������ᣨHA�����־�������������A-����֪25��ʱ��HA��Ka=6.25��10-5��H2CO3��Ka1=4.17��10-7��Ka2=4.90��10-11��������̼�����ϵĹ����У���������NaA�⣬�����ѹ����CO2���壮����˵����ȷ���ǣ��¶�Ϊ25�棬�����������������ɷ֣���������| A�� | �����δ��CO2�����ϣ�̼�����ϵ��־������ϵ� | |
| B�� | ���CO2����ѹ����������c��A-������ | |
| C�� | ��pHΪ5.0ʱ��������$\frac{c��HA��}{c��{A}^{-}��}$=0.16 | |
| D�� | ̼�������и������ӵ�Ũ�ȹ�ϵΪ��c��H+��=c��HCO${\;}_{3}^{-}$��+2c��CO${\;}_{3}^{2-}$��+c��OH-�� |
7�����շ�����һ�ְ�ɫ���壬������ˮ�������ڻ�е�豸���������������̿���Ҫ�ɷ�ΪMnO2��������������Fe2O3��FeO��Al2O3��Ϊԭ���Ʊ����շ��ε�������ͼ��
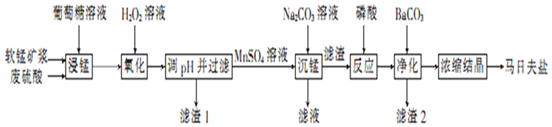
��1�����̿�Ҫ���Ƴɿ�Ŀ��������Ӧ��Ӵ�������ӿ췴Ӧ���ʣ����ԭ�������ʣ������ǣ�C6H12O6����MnO2��Ӧʱ������ΪMnSO4��CO2��H2O���÷�Ӧ���������뻹ԭ�������ʵ���֮��Ϊ12��1��
��2����H2O2��Һ��������ʱ������Ӧ�����ӷ���ʽΪ2Fe2++H2O2+2H+�T2Fe3++2H2O��
��3����֪���ֽ������ӵ��������↑ʼ��������ȫ������pH�����ʾ������pH�����ˡ�ʱ��Ӧ������pH��ΧΪ5.0��7.8������1����Ҫ�ɷ�ΪFe��OH��3��Al��OH��3���ѧʽ����
��4���������������Ӧ�Ļ�ѧ����ʽΪMnCO3+2H3PO4�TMn��H2PO4��2+CO2��+H2O��
��5��ij���������������Ʊ����շ��Σ���֪���̿���MnO2�ĺ���Ϊ87%��������������Ԫ�ص������Ϊ9%����1t�����̿���Ƶ����շ���2.5935t��

��1�����̿�Ҫ���Ƴɿ�Ŀ��������Ӧ��Ӵ�������ӿ췴Ӧ���ʣ����ԭ�������ʣ������ǣ�C6H12O6����MnO2��Ӧʱ������ΪMnSO4��CO2��H2O���÷�Ӧ���������뻹ԭ�������ʵ���֮��Ϊ12��1��
��2����H2O2��Һ��������ʱ������Ӧ�����ӷ���ʽΪ2Fe2++H2O2+2H+�T2Fe3++2H2O��
��3����֪���ֽ������ӵ��������↑ʼ��������ȫ������pH�����ʾ������pH�����ˡ�ʱ��Ӧ������pH��ΧΪ5.0��7.8������1����Ҫ�ɷ�ΪFe��OH��3��Al��OH��3���ѧʽ����
| �������� | ��ʼ������pH | ��ȫ������pH |
| Fe3+ | 1.8 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
| Mn2+ | 7.8 | 9.8 |
��5��ij���������������Ʊ����շ��Σ���֪���̿���MnO2�ĺ���Ϊ87%��������������Ԫ�ص������Ϊ9%����1t�����̿���Ƶ����շ���2.5935t��
14�����й��������仯�����������ȷ���ǣ�������
| A�� | ������������θ����кͼ� | B�� | ��ҵ�ϲ��õ�������Ȼ������� | ||
| C�� | ���ɾ�ʢʳ�� | D�� | ����������ˮ�����漰��ѧ�仯 |
11��CO��CH4�Ļ��������ǡ���ڵ����O2����ȫȼ�գ���ԭ���������CO��CH4�������Ϊ��������
| A�� | 1��1 | B�� | 2��1 | C�� | 1��2 | D�� | 3��1 |
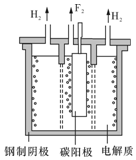 ������Ȼ���й㷺�ֲ���Ԫ��֮һ�����ڷ������⻯ѧ���ʣ���������±���ڵ��ʼ���������Ʊ��������ϴ��ڽ����ԵIJ��죮
������Ȼ���й㷺�ֲ���Ԫ��֮һ�����ڷ������⻯ѧ���ʣ���������±���ڵ��ʼ���������Ʊ��������ϴ��ڽ����ԵIJ��죮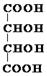 ��
��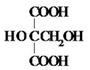 ��M�ĺ˴Ź�������ͼ����4�����շ壮
��M�ĺ˴Ź�������ͼ����4�����շ壮