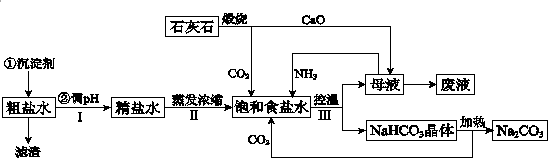
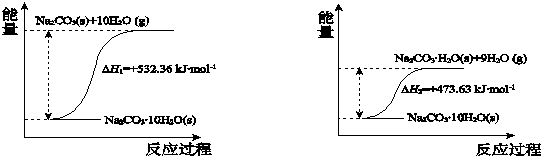
题目内容
18.下列说法正确的是( )| A. | 足量Cu与浓硫酸反应后,向溶液中加入NaNO3,无任何现象 | |
| B. | 实验室检验氨气是将湿润的蓝色石蕊试纸靠近瓶口或管口,观察试纸是否呈红色 | |
| C. | 灼热的铂丝与NH3、O2混合气接触,铂丝持续红热,说明氮的氧化反应是放热反应 | |
| D. | 大气污染气体很难处理,是因为NO等在空气中都能稳定存在 |
分析 A.硝酸根离子在酸性条件下具有强氧化性;
B.氨气可使红色石蕊试纸变蓝色;
C.铂丝持续红热,可说明反应放热;
D.NO易与空气中的氧气反应.
解答 解:A.硝酸根离子在酸性条件下具有强氧化性,足量Cu与浓硫酸反应后,向溶液中加入NaNO3,发生氧化还原反应,铜溶解,且由气体生成,故A错误;
B.氨气可使红色石蕊试纸变蓝色,故B错误;
C.氨气和氧气在铂丝的催化下发生氧化还原反应,铂丝持续红热,可说明反应放热,故C正确;
D.NO易与空气中的氧气反应,在空气中不能稳定存在,故D错误.
故选C.
点评 本题综合考查元素化合物知识,为高考常见题型,侧重于双基的考查,有利于培养学生良好的科学素养,注意相关基础知识的积累,难度不大.

练习册系列答案
相关题目
9.下列有关有机物同分异构体说法中不正确的是( )
| A. | 分子式为C4H8的同分异构体共有(不考虑立体异构)5种 | |
| B. | 苯的四氯取代物有3种 | |
| C. | 分子式为C5H10O2的同分异构体中属于酯的有8种 | |
| D. | 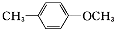 的一溴取代物有4种 的一溴取代物有4种 |
6.已知四种主族元素的离子aWm+、bXn+、cYm-、dZn-具有相同的电子层结构,下列说法正确的是( )
| A. | 若m>n,金属性W>X | |
| B. | 若m>n,气态氢化物的稳定性HmY>HnZ | |
| C. | 若m<n,氧化性Xn+>Wm+ | |
| D. | 若m<n,原子序数a>b>c>d |
13.下列物质属于可溶性的是( )
| A. | Fe(OH)3 | B. | Cu(OH)2 | C. | Al(OH)3 | D. | Ba(OH)2 |
10.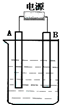 在如图用石墨作电极的电解池中,放入500mL含硫酸铜的溶液进行电解,当电解一会后(时间为t)观察到A电极表面有红色的固态物质生成,B电极有无色气体生成,溶液还是蓝色的;反接电源,再电解相同时间(时间为t),则下列说法正确的是( )
在如图用石墨作电极的电解池中,放入500mL含硫酸铜的溶液进行电解,当电解一会后(时间为t)观察到A电极表面有红色的固态物质生成,B电极有无色气体生成,溶液还是蓝色的;反接电源,再电解相同时间(时间为t),则下列说法正确的是( )
 在如图用石墨作电极的电解池中,放入500mL含硫酸铜的溶液进行电解,当电解一会后(时间为t)观察到A电极表面有红色的固态物质生成,B电极有无色气体生成,溶液还是蓝色的;反接电源,再电解相同时间(时间为t),则下列说法正确的是( )
在如图用石墨作电极的电解池中,放入500mL含硫酸铜的溶液进行电解,当电解一会后(时间为t)观察到A电极表面有红色的固态物质生成,B电极有无色气体生成,溶液还是蓝色的;反接电源,再电解相同时间(时间为t),则下列说法正确的是( )| A. | 一开始A接的是电源的负极 | |
| B. | 反接电源后B电极发生氧化反应 | |
| C. | 反接电源后电解时A电极发生反应的电极反应式4OH--4e-=2H2O+O2↑ | |
| D. | 反接电源后,电解池变成了电镀池,实现了碳(B电极)上镀铜. |
7.下表是某地区市场上销售的一种“加碘食盐”包装袋上的部分文字说明.请根据此表,结合初中化学和生物学科的知识,回答下列问题.
(1)要在食盐中加碘,是因为碘是人体内合成甲状腺激素的主要原料,缺碘会引起疾病.在人体中,碘是属于微量(选填“常量”或“微量”)元素.
(2)食盐中加碘,这碘指的是元素(填元素、原子或单质).
(3)碘酸钾的化学式为KIO3,其中碘元素的化合价为+5.
(4)根据含碘盐的食用方法可推测碘元素的化学性质,碘酸钾在受热时是分解(容易还是不容易)分解.
| 配料表 | 精制海盐、碘酸钾 |
| 含碘量 | 20~40mg/kg |
| 卫生许可证号 | ××卫碘字(1999)第001号 |
| 分装日期 | 见封底 |
| 储藏方法 | 密封、避光、防潮 |
| 食用方法 | 烹调时,待食品熟后加入碘盐 |
(2)食盐中加碘,这碘指的是元素(填元素、原子或单质).
(3)碘酸钾的化学式为KIO3,其中碘元素的化合价为+5.
(4)根据含碘盐的食用方法可推测碘元素的化学性质,碘酸钾在受热时是分解(容易还是不容易)分解.
8.居里夫人因对Ra(镭)元素的研究两次获得诺贝尔奖.人们在测定物质放射性时通常用${\;}_{88}^{226}$Ra作为标准.下列有关${\;}_{88}^{226}$Ra的说法不正确的是( )
| A. | ${\;}_{88}^{226}$Ra的质量数为226,在数值上等于该原子的近似相对原子质量 | |
| B. | Ra元素位于周期表中第六周期第ⅡA族 | |
| C. | ${\;}_{88}^{226}$Ra元素的金属性比Mg的强 | |
| D. | Ra的最高价氧化物对应的水化物是强碱 |