题目内容
4.铁、铝、铜及其化合物在生产、生活中有广泛的用途,试回答下列问题:(1)制造电路板的工艺中,FeCl3溶液可以蚀刻铜箔,请写出该反应的离子方程式2Fe3++Cu=2Fe2++Cu2+;
(2)已知铜与稀硫酸不反应,但将铜片在稀硫酸中长时间加热时溶液会呈蓝色,请用化学方程式表示原因2Cu+O2+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2CuSO4+2H2O.
(3)氯化铝广泛用于有机合成和石油工业的催化剂.将铝土矿粉(主要成分为Al2O3)与焦炭混合后加热并通入氯气,可得到氯化铝,同时生成CO,写出该反应的化学方程式Al2O3+3Cl2+3C$\frac{\underline{\;\;△\;\;}}{\;}$2AlCl3+3CO.
(4)已知Cu2S可以和硝酸反应,请配平下列化学反应方程式:
□Cu2S+□HNO3 $\frac{\underline{\;\;△\;\;}}{\;}$□CuSO4+□Cu(NO3)2+□NO↑+□H2O
(5)某校兴趣小组欲测定一种铁铝硅合金(FexAlySiz)粉末的组成,提出如下方案:准确称取1.46g该合金粉末,加入过量盐酸溶液充分反应后过滤,测定剩余固体质量0.07g.向滤液中滴加足量浓NaOH溶液,充分搅拌、过滤、洗涤得固体.再将所得固体充分加热、灼烧得红棕色粉末1.60g,通过计算确定此合金的组成为Fe8Al4Si(填化学式).
分析 (1)Cu与氯化铁反应生成氯化铜、氯化亚铁;
(2)铜片在稀硫酸中长时间加热时溶液会呈蓝色,氧气参加反应,生成硫酸铜和水;
(3)Al2O3与焦炭混合后加热并通入氯气,可得到氯化铝,同时生成CO,由反应物、生成物可知反应方程式;
(4)Cu、S元素的化合价升高,N元素的化合价降低,结合电子、原子守恒配平反应;
(5)合金溶于过量盐酸铁和铝反应,剩余固体质量为硅的质量,计算得到n(Si),加入过量氢氧化钠溶液铝离子反应全部变化为偏铝酸钠,铁离子生成氢氧化铁过滤、洗涤得固体.再将所得固体充分加热、灼烧,得红棕色粉末1.60g为Fe2O3,计算得到铁元素物质的量,结合质量守恒计算合金中铝元素物质的量得到化学式.
解答 解:(1)FeCl3蚀刻铜箔反应是三价铁离子具有氧化性和铜反应生成亚铁离子和铜离子,由电子、电荷守恒可知反应的离子方程式为2Fe3++Cu=2Fe2++Cu2+,
故答案为:2Fe3++Cu=2Fe2++Cu2+;
(2)因溶液中有氧气,加热能与铜反应生成氧化铜:2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO,氧化铜再与硫酸反应:CuO+H2SO4=CuSO4+H2O,两式相加可得2Cu+O2+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2CuSO4+2H2O,
故答案为:2Cu+O2+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2CuSO4+2H2O;
(3)根据题意知,反应物是氧化铝、碳和氯气,反应条件是加热,生成物是氯化铝和一氧化碳,所以其反应方程式为:Al2O3+3C+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2AlCl3+3CO,
故答案为:Al2O3+3Cl2+3C$\frac{\underline{\;\;△\;\;}}{\;}$2AlCl3+3CO;
(4)在Cu2S中:
Cu+1→+2↑,失去电子为(2-1)×2
S-2→+6,失去电子为+6-(-2)
化合价共升高10,
而HNO3中N+5→+2化合价降低3,根据化合价的升降守恒:
3Cu2S+□HNO3$\frac{\underline{\;\;△\;\;}}{\;}$□CuSO4+□Cu(NO3)2+10NO↑+( )
再根据原子守恒得:S守恒:3Cu2S+□HNO3$\frac{\underline{\;\;△\;\;}}{\;}$3CuSO4+□Cu(NO3)2+10NO↑+( )
Cu守恒:3Cu2S+□HNO3$\frac{\underline{\;\;△\;\;}}{\;}$3CuSO4+3Cu(NO3)2+10NO↑+( )
N守恒:3Cu2S+16HNO3$\frac{\underline{\;\;△\;\;}}{\;}$3CuSO4+3Cu(NO3)2+10NO↑+( )
质量守恒得:3Cu2S+16HNO3$\frac{\underline{\;\;△\;\;}}{\;}$3CuSO4+3Cu(NO3)2+10NO↑+8 H2O
故答案为:3;16;3;3;10;8;H2O;
(5)准确称取1.46g该合金粉末,加入过量盐酸溶液,充分反应后过滤,铁和铝全部溶解,测定剩余固体质量0.07g为硅.n(Si)=$\frac{0.07g}{28g/mol}$=0.0025mol,向滤液中滴加足量NaOH浓溶液,铝离子反应生成偏铝酸钠,充分搅拌、过滤、洗涤得固体.判断为Fe(OH)3,再将所得固体充分加热、灼烧,得红棕色粉末1.60g为Fe2O3,铁的物质的量n(Fe)=$\frac{1.60g}{160g/mol}$×2=0.02mol,n(Al)=$\frac{1.46g-0.07g-0.02mol×56g/mol}{27g/mol}$=0.01mol;
n(Fe):n(Al):n(Si)=0.02:0.01:0.0025=8:4:1,所以化学式为Fe8Al4Si,
故答案为:Fe8Al4Si.
点评 本题考查常见金属及化合物的性质,为高频考点,把握物质的性质、发生的反应为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的综合应用,(5)中计算为解答的难点,题目难度中等.

 小学课时特训系列答案
小学课时特训系列答案①混合气体的平均相对分子质量; ②混合气体的密度; ③B的物质的量浓度;
④气体总物质的量; ⑤混合气体的压强 ⑥C、D反应速率的比值.
| A. | ②③⑤ | B. | ②③④⑥ | C. | ①③④⑤ | D. | ①②③ |
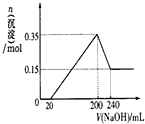
| A. | 混合物中Fe和Cu的物质的量之比为3:2 | |
| B. | 消耗NaOH溶液体积为260mL | |
| C. | 所得沉淀的质量m=9.83g | |
| D. | 混合物消耗HNO3的物质的量为0.46mol |
完成下列填空:
(1)目前国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为:
CO2(g)+4H2(g)?CH4(g)+2H2O(g)
已知H2的体积分数随温度的升高而增加.
若温度从300℃升至400℃,重新达到平衡,判断下列表格中各物理量的变化.(选填“增大”、“减小”或“不变”)
| v正 | v逆 | 平衡常数K | 转化率α |
| [CO2]/mol•L-1 | [H2]/mol•L-1 | [CH4]/mol•L-1 | [H2O]/mol•L-1 | |
| 平衡Ⅰ | a | b | c | d |
| 平衡Ⅱ | m | n | x | y |
(3)碳酸:H2CO3,Ki1=4.3×10-7,Ki2=5.6×10-11
草酸:H2C2O4,Ki1=5.9×10-2,Ki2=6.4×10-5
0.1mol/L Na2CO3溶液的pH大于0.1mol/L Na2C2O4溶液的pH.(选填“大于”“小于”或“等于”)
等浓度的草酸溶液和碳酸溶液中,氢离子浓度较大的是草酸.若将等浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种离子浓度大小的顺序正确的是ac.(选填编号)
a.[H+]>[HC2O4-]>[HCO3-]>[CO32-]b.[HCO3-]>[HC2O4-]>[C2O42-]>[CO32-]
c.[H+]>[HC2O4-]>[C2O42-]>[CO32-]d.[H2CO3]>[HCO3-]>[HC2O4-]>[CO32-]
(4)人体血液中的碳酸和碳酸氢盐存在平衡:H++HCO3-?H2CO3,当有少量酸性或碱性物质进入血液中时,血液的pH变化不大,用平衡移动原理解释上述现象当少量酸性物质进入血液中,平衡向右移动,使H+浓度变化较小,血液中的pH基本不变;当少量碱性物质进入血液中,平衡向左移动,使H+浓度变化较小,血液的pH基本不变.
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
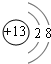 ,非金属性最强的是F.
,非金属性最强的是F.(2)①~⑩中元素的最高价氧化物对应的水化物中酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3;氢化物最稳定的是HF.
(3)按要求写出下列两种物质的电子式:⑥的氢化物
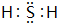 ;含有化合价为+1价的⑦的具有漂白性的一种含氧酸
;含有化合价为+1价的⑦的具有漂白性的一种含氧酸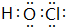 ;
;(4)在⑦与⑩对应的两种单质中,化学性质较活泼的是Cl2,可用什么化学反应证明明该事实(写出反应的化学方程式):2NaBr+Cl2=2NaCl+Br2.
| A. | H2和D2 | B. | 白磷和红磷 | C. | 16O和18O | D. | 24Mg和24Na |
 .
. 3,5,5-三甲基辛烷
3,5,5-三甲基辛烷 3,4,4-三甲基-1-戊炔
3,4,4-三甲基-1-戊炔 1,3-二氯戊烷
1,3-二氯戊烷 1-甲基-4-乙基苯
1-甲基-4-乙基苯
 A、B、C、D均为中学化学中常见的物质,它们之间转化关系如图(部分产物已略去):A$→_{一定条件}^{+D}$B$→_{一定条件}^{+D}$C
A、B、C、D均为中学化学中常见的物质,它们之间转化关系如图(部分产物已略去):A$→_{一定条件}^{+D}$B$→_{一定条件}^{+D}$C