题目内容
20.某种镍氢电池的电解质为7mol•L-1的KOH溶液,该电池的充电总反应为:M+Ni(0H)2=MH+NiOOH,其中MH为金属储氢材料.①NiOOH中Ni元素的化合价为+3
②该电池放电时的负极材料为MH+OH--e-═M+H2O.正极的电极反应式为NiOOH+H2O+e-=Ni(OH)2+OH-.
分析 ①该化合物中O元素为-2价、H元素化合价为+1价,根据化合物中各元素化合价的代数和为0确定Ni元素化合价;
②充电时电池反应式与放电时电池反应式正好相反,充电总反应为:M+Ni(0H)2=MH+NiOOH,则放电总反应为MH+NiOOH=M+Ni(0H)2,放电时,负极上MH失电子发生氧化反应,正极上Ni(0H)2得电子发生还原反应.
解答 解:①该化合物中O元素为-2价、H元素化合价为+1价,根据化合物中各元素化合价的代数和为0确定Ni元素化合价为+3,故答案为:+3;
②充电时电池反应式与放电时电池反应式正好相反,充电总反应为:M+Ni(0H)2=MH+NiOOH,则放电总反应为MH+NiOOH=M+Ni(0H)2,放电时,负极上MH失电子发生氧化反应,电极反应式为MH+OH--e-═M+H2O,正极上Ni(0H)2得电子发生还原反应,电极反应式为NiOOH+H2O+e-=Ni(OH)2+OH-,
故答案为:MH+OH--e-═M+H2O;NiOOH+H2O+e-=Ni(OH)2+OH-.
点评 本题考查化学电源新型电池,为高频考点,明确原电池和电解池反应式关系是解本题关键,会根据元素化合价变化确定正负极、阴阳极发生的反应,难点是电极反应式的书写.

练习册系列答案
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案
相关题目
10.下列有关电池的说法不正确的是( )
| A. | 铅蓄电池属于二次电池 | |
| B. | 锂离子电池是一种一次性电池 | |
| C. | 氢氧燃料电池可把化学能转化为电能 | |
| D. | 镍镉电池中,Cd为负极,NiO(OH)为正极 |
11.下列物质属于离子化合物的是( )
| A. | HCl | B. | H2SO4 | C. | H2O | D. | CaCl2 |
8.生活中的某些问题,常常涉及到化学知识,下列分析正确的是( )
| A. | 氯气和活性炭均可作为漂白剂,若同时使用,漂白效果会明显加强 | |
| B. | 为了消除碘缺乏病,卫生部规定食盐必须加碘,其中碘以单质的形式存在 | |
| C. | 用浸泡过高锰酸钾溶液的硅藻土吸收水果产生的乙烯以达到保险要求 | |
| D. | 苯酚有杀菌和止痛作用,药皂中也掺有少量苯酚,所以可以用苯酚对环境消毒或直接涂抹于皮肤上进行消毒 |
5.甲、乙、丙三种可溶性盐,其中所含阳离子的原子序数依次增大,现将等物质的量的三种物质混合后溶于水,产生白色沉淀,溶液中还含有下列五种离子:Al3+、Na+、NO3-、Cl-、SO42-.下列有关说法不正确的是( )
| A. | 丙的阳离子可能不是主族元素 | B. | 乙可能是硝酸铝 | ||
| C. | 甲可能是硫酸钠 | D. | 所得溶液呈弱酸性 |
12.下列实验中,对应的现象以及结论都正确的是( )
| 选项 | 实验 | 现象 | 结论 |
| A | 向碳酸钠溶液中滴入酚酞试液,加热 | 溶液红色加深 | 碳酸钠水解吸热 |
| B | NaAlO2溶液与NaHCO3溶液混合 | 有白色絮状沉淀生成 | 二者水解相互促进生成氢氧化铝沉淀 |
| C | 向Fe(NO3)2溶液中先滴入KSCN溶液再滴加盐酸 | 加入盐酸后溶液变成血红色 | Fe2+被盐酸氧化为Fe3+ |
| D | 向1mL0.1mol/LMgSO4溶液中滴入10mL等浓度的NaOH溶液,片刻后再滴加0.1mol/LCuSO4溶液 | 先有白色沉淀生成后变为蓝色沉淀 | Cu(OH)2的溶度积常数比Mg(OH)2的小 |
| A. | A | B. | B | C. | C | D. | D |
14.下列有关物质结构的说法中,正确的是( )
| A. | 用VSEPR理论预测BF3和NF3的立体构型均为平面三角形 | |
| B. | CO2是直线形分子,其中碳原子的杂化轨道类型为sp3杂化 | |
| C. | 电子层结构相同的简单离子,其半径随核电荷数增大而减小 | |
| D. | 在化学反应中,某元素由化合态变为游离态,则该元素一定被还原 |
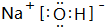 ,该化合物中所含的化学键有离子键、共价键.
,该化合物中所含的化学键有离子键、共价键. 如图所示,将4molSO2和2molO2混合置于体积可变的等压容器中,在一定温度下发生如下反应:2SO2(g)+O2(g)?2SO3(g);△H<0.该反应达到平衡状态A 时,测得气体总物质的量为4.2mol.若SO2、O2、SO3的起始物质的量分别用a、b、c表示,回答下列问题:
如图所示,将4molSO2和2molO2混合置于体积可变的等压容器中,在一定温度下发生如下反应:2SO2(g)+O2(g)?2SO3(g);△H<0.该反应达到平衡状态A 时,测得气体总物质的量为4.2mol.若SO2、O2、SO3的起始物质的量分别用a、b、c表示,回答下列问题: