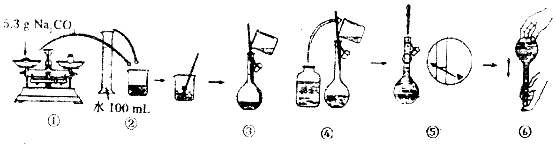
题目内容
16.除去下列物质中混有的少量杂质(杂质不要求回收),把适当的试剂、操作方法的序号写在相应的括号内.a.加适量的水、过滤 b.加热(高温或灼烧) c.加适量的盐酸、蒸发 d.冷却热的饱和溶液、过滤
(1)碳酸钙中混有少量的碳酸钠a
(2)氯化钾粉末中混有少量碳酸钾c
(3)氧化钙中混有少量的碳酸钙b
(4)硝酸钾中混有少量的食盐d.
分析 (1)碳酸钙不溶于水,碳酸钠能溶于水;
(2)碳酸钾与盐酸反应生成氯化钾;
(3)碳酸钙高温分解生成氧化钙;
(4)二者的溶解度受温度影响不同.
解答 解:(1)碳酸钙不溶于水,碳酸钠能溶于水,则加适量水,过滤可分离,故答案为:a;
(2)碳酸钾与盐酸反应生成氯化钾,则加适量盐酸,蒸发可得到KCl,故答案为:c;
(3)碳酸钙高温分解生成氧化钙,则加热(高温或灼烧)可除杂,故答案为:b;
(4)二者的溶解度受温度影响不同,则冷却热的饱和溶液,过滤可除杂,故答案为:d.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异及发生的反应为解答的关键,侧重分析、应用及除杂的考查,注意除杂的方法和原则,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
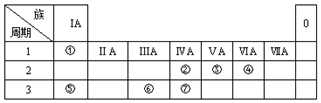
13.根据元素周期表和元素周期律,分析下面的推断,其中错误的是( )
| A. | 铍的原子失电子能力比镁弱 | B. | 砹(At)的氢化物不稳定 | ||
| C. | 硒的原子半径比硫小 | D. | Sr(OH)2 比Ca(OH)2 碱性强 |
7.研究催化剂对化学反应有重要意义.为探究催化剂对双氧水分解的催化效果,某研究小组做了如下实验:
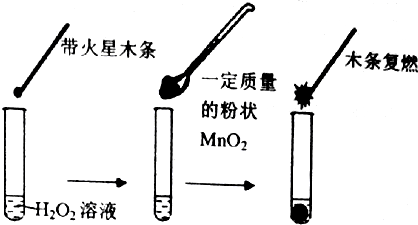
(1)甲同学欲用图所示实验来证明MnO2是H2O2分解反应的催化剂. 该实验不能 (填“能”或“不能”)达到目的,原因是因为没有确认MnO2的质量和性质是否改变.(若能,不必回答原因)
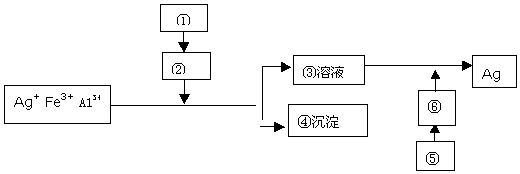
(2)为分析Fe3+和Cu2+对H2O2分解反应的催化效果,丙同学设计如下实验(三支试管中均盛有10mL5%H2O2)
由此得到的结论是Fe3+和Cu2+对H2O2的分解均有催化作用,且Fe3+比Cu2+催化效果好,设计实验Ⅲ的目的是对比实验,证明Cl-对H2O2的分解没有催化作用.
(3)在上述实验过程中,分别检测出溶液中有二价铁生成,查阅资料得知:将作为催化剂的FeCl3溶液加入H2O2溶液后,溶液中会发生两个氧化还原反应,且两个反应中H2O2均参加了反应,试从催化剂的角度分析,这两个氧化还原反应的化学方程式分别是2FeCl3+H2O2=2FeCl2+O2↑+2HCl和2FeCl2+H2O2+2HCl=2FeCl3+2H2O(按反应发生的顺序写).

(1)甲同学欲用图所示实验来证明MnO2是H2O2分解反应的催化剂. 该实验不能 (填“能”或“不能”)达到目的,原因是因为没有确认MnO2的质量和性质是否改变.(若能,不必回答原因)
(2)为分析Fe3+和Cu2+对H2O2分解反应的催化效果,丙同学设计如下实验(三支试管中均盛有10mL5%H2O2)
| 试管 | Ⅰ | Ⅱ | Ⅲ |
| 滴加试剂 | 5滴0.1mol•L-1FeCl3 | 5滴0.1mol•L-1 CuCl2 | 5滴0.3mol•L-1 NaCl |
| 产生气泡情况 | 较快产生细小气泡 | 缓慢产生细小气泡 | 无气泡产生 |
(3)在上述实验过程中,分别检测出溶液中有二价铁生成,查阅资料得知:将作为催化剂的FeCl3溶液加入H2O2溶液后,溶液中会发生两个氧化还原反应,且两个反应中H2O2均参加了反应,试从催化剂的角度分析,这两个氧化还原反应的化学方程式分别是2FeCl3+H2O2=2FeCl2+O2↑+2HCl和2FeCl2+H2O2+2HCl=2FeCl3+2H2O(按反应发生的顺序写).
4.下列关于碳原子的成键特点及成键方式的理解,正确的是( )
| A. | 饱和机物中碳原子不能发生化学反应 | |
| B. | C原子只能与C原子形成不饱和键 | |
| C. | 任何有机物中H原子数目不可能为奇数 | |
| D. | 五个C原子之间能够形成五个碳碳单键 |
11.下列反应的离子方程式书写正确的是( )
| A. | Fe和醋酸反应:Fe+2H+═Fe2++H2↑ | |
| B. | 大理石和稀盐酸反应:CO32-+2H+═CO2↑+H2O | |
| C. | FeCl2溶液与Cl2的反应:2Fe2++Cl2═2Fe3++2Cl- | |
| D. | Cl2与H2O反应:Cl2+H2O═2H++Cl-+ClO- |
6.某硫酸铝溶液中,含 Al3+ a g,则溶液中 SO42- 的物质的量为( )
| A. | $\frac{3a}{2}$ mol | B. | $\frac{a}{18}$ mol | C. | $\frac{a}{27}$ mol | D. | $\frac{a}{96}$ mol |
 ,乙是一种常用的还原剂,请用化学方程式表示它在工业上的一种重要用途:3CO+Fe2O3$\frac{\underline{\;\;△\;\;}}{\;}$2Fe+3CO2.
,乙是一种常用的还原剂,请用化学方程式表示它在工业上的一种重要用途:3CO+Fe2O3$\frac{\underline{\;\;△\;\;}}{\;}$2Fe+3CO2.