题目内容
设NA为阿伏加德罗常数的数值.下列说法正确的是(用到的相对原子质量:H 1 O16 Al27)( )
| A、18g 2H2O含有10NA个电子 |
| B、1mol苯含有6NA个C-H键 |
| C、常温常压下,22.4L NH3约含有NA个NH3分子 |
| D、27g铝片投入足量浓H2SO4中生成1.5NA个SO2分子 |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.该水的摩尔质量为20g/mol;
B.1mol苯中含有6mol碳氢键;
C.常温常压下Vm≠22.4L/mol;
D.铝在浓硫酸中发生钝化.
B.1mol苯中含有6mol碳氢键;
C.常温常压下Vm≠22.4L/mol;
D.铝在浓硫酸中发生钝化.
解答:
解:A.根据n=
,18g重水的物质的量为0.9mol,含有9mol电子,含有的电子数为9NA,故A错误;
B.1mol苯中含有6mol碳氢键,即6NA个C-H键,故B正确;
C.常温常压下Vm≠22.4L/mol,故22.4L NH3的物质的量不是1mol,故C错误;
D.铝在浓硫酸中发生钝化,不能继续反应,故D错误.
故选B.
| m |
| M |
B.1mol苯中含有6mol碳氢键,即6NA个C-H键,故B正确;
C.常温常压下Vm≠22.4L/mol,故22.4L NH3的物质的量不是1mol,故C错误;
D.铝在浓硫酸中发生钝化,不能继续反应,故D错误.
故选B.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意明确标况下气体摩尔体积的使用条件,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系;试题有利于提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
下列关于能源和作为能源的物质的叙述错误的是( )
| A、吸热反应的反应物总能量低于生成物总能量 |
| B、绿色植物进行光合作用时,将光能转化为化学能“贮存”起来 |
| C、物质的化学能可以在不同条件下转为热能、电能、光能等为人类所利用 |
| D、天然气属于二次能源 |
下列离子方程式书写正确的是( )
| A、将铝片放入过量NaOH溶液中:2Al+2OH-═2AlO2-+H2↑ |
| B、硫酸铝溶液中加入过量的氨水:Al3++3NH3?H2O═Al(OH)3↓+3NH4+ |
| C、硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ |
| D、铜片插入硝酸银溶液中 Cu+Ag+═Cu2++Ag |
下列两种气体的分子数一定相等的是( )
| A、质量相等、密度不等的氮气和二氧化碳 |
| B、等体积、等密度的一氧化碳和氮气 |
| C、等温、等体积的氧气和氮气 |
| D、等压强、等体积的氮气和二氧化碳 |
用NA表示阿伏德罗常数,下列叙述正确的是( )
| A、标准状况下,22.4LH2O含有的分子数为NA |
| B、通常状况下,NA个CO2分子占有的体积为22.4L |
| C、物质的量浓度为1mol/L的MgCl2溶液中,含有Cl-个数为2NA |
| D、常温常压下,1.06gNa2CO3含有的Na+离子数为0.02NA |
不能实现下列物质间直接转化的元素是( )
单质氧化物
氧化物
酸或碱
盐.
单质氧化物
| +O2 |
| +H2O |
| +NaOH或HCl |
| A、氮 | B、硫 | C、碳 | D、铁 |
某学生用NaHCO3和KHCO3组成的某混合物进行实验,测得如下数据(盐酸的物质的量浓度相等):
则下列分析推理中不正确的是( )
| Ⅰ | Ⅱ | Ⅲ | |
| 50mL盐酸 | 50mL盐酸 | 50mL盐酸 | |
| m(混合物) | 9.2g | 13.8g | 14.2g |
| V(CO2)(标况) | 2.24L | 3.36L | 3.36L |
| A、根据表中第Ⅱ组数据不能计算出混合物中NaHCO3的质量分数 |
| B、加入混合物9.2g时盐酸过量 |
| C、盐酸的物质的量浓度为3.0mol?L-1 |
| D、13.8g混合物恰好与盐酸完全反应 |
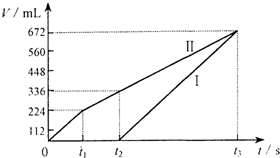 常温下电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如图所示(气体体积已换算成标准状况下的体积),根据图中信息(Ⅰ、Ⅱ两极分别代表两极各自产生的气体体积),通过计算推测:
常温下电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如图所示(气体体积已换算成标准状况下的体积),根据图中信息(Ⅰ、Ⅱ两极分别代表两极各自产生的气体体积),通过计算推测: