题目内容
6.NH3及其盐都是重要的化工原料.(1)用NH4Cl和Ca(OH)2制备NH3,反应发生、气体收集和尾气处理装置依次为ACG(如图1)

(2)按图2装置进行NH3性质实验.
①先打开旋塞1,B瓶中的现象是产生白烟,原因是A瓶压强比B瓶大,氯化氢进入B瓶与氨气反应生成氯化铵固体小颗粒形成白烟,稳定后,关闭旋塞1.
②再打开旋塞2,B瓶中的现象是烧瓶中的液体倒吸入B瓶,且紫色石蕊试液变红.

分析 (1)实验室用NH4Cl和Ca(OH)2制备NH3,依据反应条件和反应物状态确定发生装置;依据氨气易溶于水,密度小于空气密度选择收集装置;依据氨气极易溶于水特点选择尾气处理装置;
(2)①据AB容器压强及AB混合后压强相等,氨气和氯化氢反应生成白色固体氯化铵分析解答;
②氨气、氯化氢为气体,反应生成的氯化铵是固体,压强减小,氯化铵为强酸弱碱盐,溶液显酸性,据此解答.
解答 解:(1)用NH4Cl和Ca(OH)2制备NH3,反应物为固体与固体,反应条件为加热,属于固体加热型,为防止反应产生的水倒流入热的试管底部引起试管炸裂,所以试管口下倾,故选发生装置A;氨气易溶于水且密度比空气小,所以只能用向下排空气法收集,故选C,氨气极易溶于水,尾气处理须考虑倒吸,倒扣 的漏斗空间大,水柱不易急速上升,能有效防止倒吸,且漏斗刚接触液面最好;
故答案为:ACG;
(2)①A容器压强为150kPa,B容器为100kPa,所以打开旋塞1,氯化氢气体进入B瓶,与氨气反应生成氯化铵小颗粒,所以B瓶中现象是产生白烟;
故答案为:产生白烟;A瓶压强比B瓶大,氯化氢进入B瓶与氨气反应生成氯化铵固体小颗粒形成白烟;
②氨气、氯化氢为气体,反应生成的氯化铵是固体,压强减小,所以再打开旋塞2,石蕊试液被吸入B瓶,氯化铵为强酸弱碱盐,溶液显酸性,则B瓶中的现象是紫色石蕊试液变红;
故答案为:烧瓶中的液体倒吸入B瓶,且紫色石蕊试液变红.
点评 本题考查了实验室制取氨气及氨气的性质检验,掌握气体制备原理及发生装置、收集装置、尾气处理装置的选择方法,熟悉物质的性质是解题关键,题目难度不大.

练习册系列答案
相关题目
3.在甲酸的下列性质中,可以证明它是弱电解质的是( )
| A. | 1mol/L的甲酸溶液中c(H+)约为0.01mol/L | |
| B. | 甲酸与活泼金属反应生成氢气 | |
| C. | 10mL1mol/L的甲酸恰好与10mL1mol/L的NaOH溶液完全反应 | |
| D. | 在相同浓度下,甲酸的导电性比二元强酸溶液的弱 |
18.化合物X的分子式为C5H11Cl,用NaOH的醇溶液处理X,可得分子式为C5H10的两种产物Y、Z,Y、Z经催化加氢后都可得到2甲基丁烷.若将化合物X用NaOH的水溶液处理,则所得有机产物的结构简式可能是( )
| A. | CH3CH2CH2CH2CH2OH | B. | (CH3)2COHCH2CH3 | ||
| C. | (CH3)2CHCH2CH2OH | D. | (CH3)3CCH2OH |
15.如图所示是一种综合处理SO2废气的工艺流程.下列说法正确的是( )
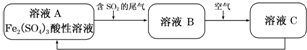

| A. | 向B溶液中滴加KSCN溶液,溶液不会变为血红色 | |
| B. | 溶液B转化为溶液C发生的变化的离子方程式为4H++2Fe2++O2═2Fe3++2H2O | |
| C. | 溶液酸性A>B>C | |
| D. | 加氧化亚铁可以使溶液C转化为溶液B |
16.下列化合物在核磁共振氢谱中能出现两组峰.且其峰面积之比为3:1的为( )
| A. | 乙酸异丙酯 | B. | 甲酸甲酯 | C. | 对二甲苯 | D. | 硝基苯 |
 和
和 
 与
与