题目内容
18.化合物X的分子式为C5H11Cl,用NaOH的醇溶液处理X,可得分子式为C5H10的两种产物Y、Z,Y、Z经催化加氢后都可得到2甲基丁烷.若将化合物X用NaOH的水溶液处理,则所得有机产物的结构简式可能是( )| A. | CH3CH2CH2CH2CH2OH | B. | (CH3)2COHCH2CH3 | ||
| C. | (CH3)2CHCH2CH2OH | D. | (CH3)3CCH2OH |
分析 能跟H2加成生成2-甲基丁烷,说明Y和Z均为分子中含5个C原子的不饱和烃,其碳骨架为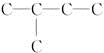 .氯代烃发生消去反应生成烯烃和烯烃加氢生成烷烃,碳架不变,故化合物X的碳架有一个支链甲基,以此解答该题.
.氯代烃发生消去反应生成烯烃和烯烃加氢生成烷烃,碳架不变,故化合物X的碳架有一个支链甲基,以此解答该题.
解答 解:能跟H2加成生成2-甲基丁烷,说明Y和Z均为分子中含5个C原子的不饱和烃,其碳骨架为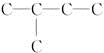 .氯代烃发生消去反应生成烯烃和烯烃加氢生成烷烃,碳架不变,故化合物X的碳架有一个支链甲基,
.氯代烃发生消去反应生成烯烃和烯烃加氢生成烷烃,碳架不变,故化合物X的碳架有一个支链甲基,
A.CH3CH2CH2CH2CH2OH没有支链,故A错误;
B.(CH3)2COHCH2CH3对应X为(CH3)2CClCH2CH3,生成的烯烃有2种,符合题目要求,故B正确;
C.(CH3)2CHCH2CH2OH对应的X发生消去反应生成一种烯烃,故C错误;
D.(CH3)3CCH2OH对应的X为(CH3)3CCH2Cl,不能发生消去反应,故D错误.
故选B.
点评 本题考查有机物的推断,为高频考点,侧重于学生的分析能力的考查,熟悉卤代烃消去的规律和烯烃的加成特点是解题的关键,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
13.三氯化氧磷(POCl3)是一种重要的化工原料,常用作半导体掺杂剂,实验室制取POCl3并测定产品含量的实验过程如下:
I.制备POCl3
采用氧气氧化液态的PCl3法,实验装置(加热及夹持装置省略)及相关信息如下:
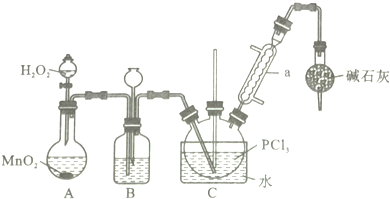
(1)仪器a的名称为冷凝管;
(2)装置C中生成POCl3的化学方程式为PCl3+H2O2=POCl3+H2O;
(3)实验中需控制通入O2的速率,对此采取的操作是控制分液漏斗中双氧水的加入量;
(4)装置B的作用除观察O2的流速之外,还有平衡气压、干燥氧气;
(5)反应温度应控制在60~65℃,原因是温度过低,反应速率小,温度过高,三氯化磷会挥发,影响产物纯度;
II.测定POCl3产品含量的实验步骤:
①实验I结束后,待三颈烧瓶中液体冷却到室温,准确称取16.725g POCl3产品,置于盛有60.00mL蒸馏水的水解瓶中摇动至完全水解,将水解液配成100.00mL溶液
②取10.00mL溶液于锥形瓶中,加入10.00mL 3.5mol/L AgNO3标准溶液(Ag++Cl-=AgCl↓)
③加入少量硝基苯(硝基苯密度比水大,且难溶于水)
④以硫酸铁溶液为指示剂,用0.2mol/L KSCN溶液滴定过量的AgNO3溶液(Ag++SCN-=AgSCN↓),到达终点时共用去10.00mL KSCN溶液.
(6)达到终点时的现象是溶液变红色;
(7)测得产品中n(POCl3)=0.11mol;
(8)已知Ksp(AgCl)>Ksp(AgSCN),据此判断,若取消步骤③,测定结果将偏低.(填偏高,偏低,或不变)
I.制备POCl3
采用氧气氧化液态的PCl3法,实验装置(加热及夹持装置省略)及相关信息如下:

| 物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其他 |
| PCl3 | -112.0 | 76.0 | 137.5 | 均为无色液体,遇水均剧烈水解为含氧酸和氯化氢,两者互溶 |
| POCl3 | 2.0 | 106.0 | 153.5 |
(2)装置C中生成POCl3的化学方程式为PCl3+H2O2=POCl3+H2O;
(3)实验中需控制通入O2的速率,对此采取的操作是控制分液漏斗中双氧水的加入量;
(4)装置B的作用除观察O2的流速之外,还有平衡气压、干燥氧气;
(5)反应温度应控制在60~65℃,原因是温度过低,反应速率小,温度过高,三氯化磷会挥发,影响产物纯度;
II.测定POCl3产品含量的实验步骤:
①实验I结束后,待三颈烧瓶中液体冷却到室温,准确称取16.725g POCl3产品,置于盛有60.00mL蒸馏水的水解瓶中摇动至完全水解,将水解液配成100.00mL溶液
②取10.00mL溶液于锥形瓶中,加入10.00mL 3.5mol/L AgNO3标准溶液(Ag++Cl-=AgCl↓)
③加入少量硝基苯(硝基苯密度比水大,且难溶于水)
④以硫酸铁溶液为指示剂,用0.2mol/L KSCN溶液滴定过量的AgNO3溶液(Ag++SCN-=AgSCN↓),到达终点时共用去10.00mL KSCN溶液.
(6)达到终点时的现象是溶液变红色;
(7)测得产品中n(POCl3)=0.11mol;
(8)已知Ksp(AgCl)>Ksp(AgSCN),据此判断,若取消步骤③,测定结果将偏低.(填偏高,偏低,或不变)
3.在氧化还原反应的过程中,氧化反应和还原反应同时发生,下列有关SO2-2e-+2H2O→SO42-+4H+的说法正确的是( )
| A. | 该反应为还原反应 | |
| B. | 上述反应中若产生0.1mol SO42-,则消耗SO2的物质的量为0.1mol | |
| C. | Fe2(SO4)3、品红两种溶液都能使上述反应进行 | |
| D. | 通入Cl2会增强SO2的漂白作用 |
10.实现下列变化需加入氧化剂的是( )
| A. | I-→I2 | B. | MnO4-→Mn2+ | C. | S2-→HS- | D. | ClO3-→Cl2 |
7.下列实验方法能够实现的是( )
| A. | 用10ml量筒量取7.5ml稀盐酸 | |
| B. | 用托盘天平称取25.20gNaCl晶体 | |
| C. | 用蒸发结晶的方法由硫酸铜溶液制取蓝帆 | |
| D. | 用100ml容量瓶配置0.5mol/l的Na2CO3溶液 |
8.利用100ml 0.5mol•L-1Na2CO3溶液配制Na+浓度为0.20mol•L-1的溶液,下列操作正确的是( )
| A. | 将该Na2CO3 溶液转移至250ml容量瓶中,加蒸馏水稀释至刻度线,摇匀 | |
| B. | 将该Na2CO3 溶液转移至250ml烧杯中,用量筒量取150ml蒸馏水加入,搅拌 | |
| C. | 将该Na2CO3 溶液转移至250ml烧杯中,用量筒量取400ml蒸馏水加入,搅拌 | |
| D. | 将该Na2CO3 溶液转移至500ml容量瓶中,加蒸馏水稀释至刻度线,摇匀 |