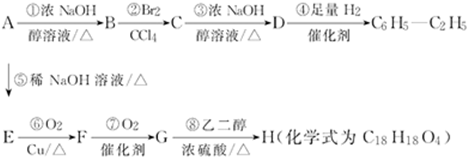
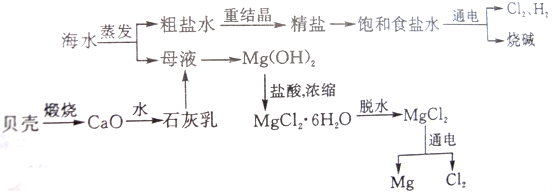
题目内容
下表是不同温度下水的离子积常数:
试回答以下问题:
(1)若25℃<t1<t2,则KW 1×10-14(填“>”、“<”或“=”),判断的理由是 .
(2)若25℃时,pH=3的盐酸和pH=11的氢氧化钠溶液等体积混合后溶液呈 性(填“酸”、“中”或“碱”),溶液中c(Na+) c(Cl-)(填“>”、“=”或“<”).
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | KW | 1×10-12 |
(1)若25℃<t1<t2,则KW
(2)若25℃时,pH=3的盐酸和pH=11的氢氧化钠溶液等体积混合后溶液呈
考点:离子积常数
专题:电离平衡与溶液的pH专题
分析:(1)水的电离过程为吸热反应,温度升高,水的电离程度增大,水的离子积增大,据此进行解答;
(2)若25℃时,pH=3的盐酸和pH=11的氢氧化钠溶液等体积混合后溶液呈中性,根据电荷守恒判断c(Na+)、c(Cl-).
(2)若25℃时,pH=3的盐酸和pH=11的氢氧化钠溶液等体积混合后溶液呈中性,根据电荷守恒判断c(Na+)、c(Cl-).
解答:
解:(1)由于水的电离电离过程为吸热反应,温度越高,水的电离程度越大,水的离子积越大,所以若25℃<t1<t2,则KW>1×10-14,
故答案为:>;因为水的电离是吸热反应,温度升高,水的电离程度增大,离子积也增大;
(2)若25℃时,pH=3的盐酸的氢离子浓度为10-3 mol/L,pH=11氢氧化钠溶液氢氧根离子浓度为
mol/L=10-3 mol/L,等体积混合溶液呈中性c(H+)=c(OH-),根据电荷守恒c(H+)+c(Na+)=c(OH-)+c(Cl-),因此c(Na+)=c(Cl-),
故答案为:中;=.
故答案为:>;因为水的电离是吸热反应,温度升高,水的电离程度增大,离子积也增大;
(2)若25℃时,pH=3的盐酸的氢离子浓度为10-3 mol/L,pH=11氢氧化钠溶液氢氧根离子浓度为
| 10-14 |
| 10-11 |
故答案为:中;=.
点评:本题考查了水的电离、溶液pH的简单计算,题目难度不大,注意掌握水的电离及溶液pH的计算方法,明确水的电离过程是吸热反应,学会利用电荷守恒比较离子浓度大小关系.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列反应属于氧化还原反应的有( )
①CaCO3
CaO+CO2↑
②2KClO3
2KCl+3O2↑
③MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
④2NaCl+H2SO4(浓)
NaSO4+2HCl↑
⑤CuO+H2SO4═CuSO4+H2O
⑥3CuO+2NH3
3Cu+N2+3H2O
⑦Cl2+H2O═HCl+HClO.
①CaCO3
| ||
②2KClO3
| ||
| △ |
③MnO2+4HCl(浓)
| ||
④2NaCl+H2SO4(浓)
| ||
⑤CuO+H2SO4═CuSO4+H2O
⑥3CuO+2NH3
| ||
⑦Cl2+H2O═HCl+HClO.
| A、全部 | B、②③⑥⑦ |
| C、②③⑤⑦ | D、①④⑤⑥ |
常温时,下列关于电解质溶液的叙述正确的是( )
| A、稀释pH=10的氨水,溶液中所有离子的浓度均降低 |
| B、pH均为5的盐酸和硫酸氢钠溶液中,水的电离程度相同 |
| C、等物质的量浓度的①NH4HSO4②NH4Cl ③CH3COONH4④(NH4)2SO4c(NH4+)的大小顺序是 ①②③④ |
| D、分别中和pH与体积均相同的硫酸和醋酸,硫酸消耗氢氧化钠的物质的量多 |
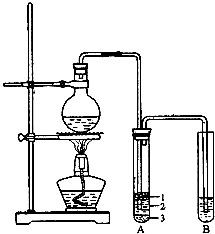 实验室制取少量溴乙烷的装置如图所示(已知溴乙烷的沸点为38.4℃).根据题意完成下列填空:
实验室制取少量溴乙烷的装置如图所示(已知溴乙烷的沸点为38.4℃).根据题意完成下列填空: