题目内容
15.在氯化镁溶液中滴加少量的氢氧化钠溶液,现象为生成白色沉淀,反应的离子方程式为Mg2++2OH-=Mg(OH)2↓,继续滴加过量的氢氧化钠溶液,现象为沉淀不溶解;在氯化铝溶液中滴加少量的氢氧化钠溶液,现象为生成白色沉淀,继续滴加过量的氢氧化钠溶液,现象为白色沉淀逐渐溶解.分析 氯化镁与氢氧化钠反应生成氢氧化镁沉淀和氯化钠;氢氧化镁不溶于氢氧化钠溶液;
氯化铝与氢氧化钠反应先生成氢氧化铝沉淀,继续加氢氧化钠,氢氧化铝与氢氧化钠反应生成四羟基合铝酸钠,据此解答.
解答 解:氯化镁与氢氧化钠反应生成氢氧化镁沉淀和氯化钠,所以会看到产生白色沉淀,反应的离子方程式:Mg2++2OH-=Mg(OH)2↓;氢氧化镁不溶于氢氧化钠溶液,所以继续加氢氧化钠,白色沉淀不溶解;
氯化铝与氢氧化钠反应先生成氢氧化铝沉淀白色沉淀,离子方程式:Al2++3OH-=Al(OH)3↓,继续加氢氧化钠,氢氧化铝与氢氧化钠反应生成四羟基合铝酸钠,离子方程式OH-+Al(OH)3=[Al(OH)4]-,现象白色沉淀逐渐溶解;
故答案为:生成白色沉淀;Mg2++2OH-=Mg(OH)2↓; 沉淀不溶解;生成白色沉淀;白色沉淀逐渐溶解.
点评 本题考查了离子方程式和化学方程式的书写,题目难度不大,明确反应的实质,熟悉化学方程式、离子方程式书写的方法和原则是解题的关键,注意氢氧化铝的两性性质.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.A、B、C、D、E为短周期的主族元素,原子序数依次增大,其中有两种是金属元素,A、B两元素一起分别与C、D、E形成的三种最常见化合物两两之间均可发生反应,下列说法中正确的是( )
| A. | 原子半径:C>D>E>A>B | |
| B. | 常见氢化物的热稳定性:B<E | |
| C. | C可分别与A、B形成共价化合物、离子化合物 | |
| D. | 制备含D、E的二元化合物时,可能需要在无水条件下进行 |
3.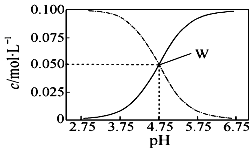 25℃,有c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的一组醋酸和醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH值的关系如图所示.下列有关离子浓度关系叙述正确的是( )
25℃,有c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的一组醋酸和醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH值的关系如图所示.下列有关离子浓度关系叙述正确的是( )
 25℃,有c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的一组醋酸和醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH值的关系如图所示.下列有关离子浓度关系叙述正确的是( )
25℃,有c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的一组醋酸和醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH值的关系如图所示.下列有关离子浓度关系叙述正确的是( )| A. | pH=5.5溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) | |
| B. | pH=3.5溶液中:c(Na+)+c(H+)+c(OH-)+c(CH3COOH)=0.1mol•L-1 | |
| C. | 该温度下醋酸的电离平衡常数为10-4.75 | |
| D. | 向W点所表示溶液中加入等体积的0.05 mol•L-1NaOH溶液:c(H+)=c(CH3COOH)+c(OH-) |
10.下列有关说法不正确的是( )
| A. | 苯与浓硝酸、浓硫酸共热并保持50~60℃反应生成硝基苯 | |
| B. | 在甲苯中加入少量酸性高锰酸钾溶液,振荡后褪色,正确的解释是由于苯环对侧链的影响,使侧链易被氧化 | |
| C. | 若甲苯苯环上的一个氢原子被一个含3个碳原子的烷基取代,所得产物有6种 | |
| D. | 菲的结构简式为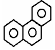 ,它与硝酸反应,可生成3种一硝基取代物 ,它与硝酸反应,可生成3种一硝基取代物 |
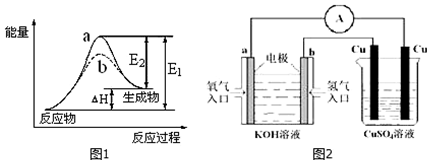
20.下列关于如图所示装置的说法,正确的是( )
| A. |  装置中阴极处产生的气体能够使湿润KI淀粉试纸变蓝 | |
| B. | 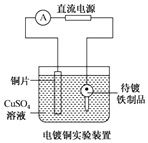 装置中待镀铁制品应与电源正极相连 | |
| C. | 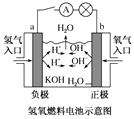 装置外电路中电子由a极流向b极 | |
| D. | 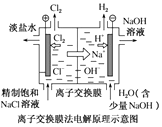 装置中的阴离子交换膜可以避免生成的Cl2与NaOH溶液反应 |
7.一定温度下,向1.0L密闭容器中加入0.60mol X(g),发生反应X(g)?Y(s)+2Z(g)△H>0,测得反应物X浓度与反应时间的数据如表:
反应开始至4min时用Z表示的平均反应速率v(Z)=0.225mol•L-1•min-1.
| 反应时间t/min | 0 | 1 | 2 | 3 | 4 |
| c(X)/(mol•L-1) | 0.60 | 0.42 | 0.30 | 0.21 | 0.15 |
5.下列离子方程式正确的是( )
| A. | 铁与FeCl3溶液反应:Fe+Fe3+═2Fe2+ | |
| B. | Fe与盐酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | FeCl2溶液与Cl2反应:Fe2++Cl2═Fe3++2Cl- | |
| D. | Fe(OH)3与盐酸反应:Fe(OH)3+3H+═Fe3++3H2O |