题目内容
下列判断合理的是( )
| A、用NaOH溶液滴定HCI与CH3COOH的混合溶液至中性时,溶液中的酸被完全中和 |
| B、0.1mol/LNa2CO3溶液35℃时的碱性比25℃时强,说明盐类水解反应是放热反应 |
| C、室温下,同浓度的Na2CO3溶液的pH比 Na2SiO3溶液的pH小,说明非金属性C>Si |
| D、焰色反应是化学变化 |
考点:影响盐类水解程度的主要因素,酸碱混合时的定性判断及有关ph的计算
专题:盐类的水解专题
分析:A、用NaOH溶液滴定HCl与CH3COOH,溶液中的酸被完全中和,混合溶液不是中性;
B、盐类水解反应是吸热反应;
C、根据越弱越水解的规律以及元素的最高价氧化物对应水化物的酸的酸性越强则元素的非金属性越强来回答;
D、焰色反应是燃烧时火焰呈现的颜色,无新物质生成.
B、盐类水解反应是吸热反应;
C、根据越弱越水解的规律以及元素的最高价氧化物对应水化物的酸的酸性越强则元素的非金属性越强来回答;
D、焰色反应是燃烧时火焰呈现的颜色,无新物质生成.
解答:
解:A、用NaOH溶液滴定HCl与CH3COOH的混合溶液至中性时,溶液中的酸未被完全中和,因为生成的醋酸钠水解显示碱性,故A错误;
B、.1mol/LNa2CO3溶液35℃时的碱性比25℃时强,是因为温度升高,离子的水解程度增大导致的,说明盐类水解反应是吸热反应,故B错误;
C、室温下,同浓度的Na2CO3溶液的pH比 Na2SiO3溶液的pH小,所以硅酸的酸性弱于碳酸,所以非金属性C>Si,故C正确;
D、焰色反应是元素具有的性质,该反应中没有新的物质生成,不属于不会变化,故D错误;
故选C.
B、.1mol/LNa2CO3溶液35℃时的碱性比25℃时强,是因为温度升高,离子的水解程度增大导致的,说明盐类水解反应是吸热反应,故B错误;
C、室温下,同浓度的Na2CO3溶液的pH比 Na2SiO3溶液的pH小,所以硅酸的酸性弱于碳酸,所以非金属性C>Si,故C正确;
D、焰色反应是元素具有的性质,该反应中没有新的物质生成,不属于不会变化,故D错误;
故选C.
点评:本题是一道盐的水解规律和应用的综合知识的考查题,注意知识的归纳和梳理是关键,难度中等.

练习册系列答案
相关题目
某有机物含有C、H、O三种元素,其中氧的质量分数25%,相对分子质量小于150,一个分子中最多含C原子个数( )
| A、10 | B、9 | C、8 | D、7 |
某学生做完实验后,采用下列方法清洗所用仪器下列对以上操作的判断.正确的是( )
①用浓氨水清洗做过银镜反应后的试管
②用酒精清洗做过碘升华的烧杯
③用浓盐酸清洗做过高锰酸钾分解实验的试管
④用盐酸清洗长期存放三氯化铁溶液的试剂瓶
⑤用氢氧化钠溶液清洗盛过苯酚的试管
⑥用热氢氧化钠的浓溶液清洗沾有硫磺的试管.
①用浓氨水清洗做过银镜反应后的试管
②用酒精清洗做过碘升华的烧杯
③用浓盐酸清洗做过高锰酸钾分解实验的试管
④用盐酸清洗长期存放三氯化铁溶液的试剂瓶
⑤用氢氧化钠溶液清洗盛过苯酚的试管
⑥用热氢氧化钠的浓溶液清洗沾有硫磺的试管.
| A、除①外都对 | B、除⑥外都对 |
| C、④⑤不对 | D、全都正确 |
下列物质性质与应用对应关系正确的是( )
| A、氧化铁能与酸反应,可用于制作红色涂料 |
| B、氢氧化铝具有弱碱性,可用于制胃酸中和剂 |
| C、生石灰能与水反应,可用来干燥氯气 |
| D、氯化铝是一种电解质,可用于电解法制铝 |
下列热化学方程式书写正确的是( )
| A、C+H2O═CO+H2△H=+131.3kJ?mol-1 | ||
B、H2(g)+
| ||
| C、2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ | ||
| D、C(s)+O2(g)═CO2(g)△H=+393.5kJ?mol-1 |
已知在室温时纯水中存在电离平衡:H2O?H++OH-.下列叙述正确的是( )
| A、同浓度、同体积的NaOH和氨水溶液中,水的电离程度相同 |
| B、升高温度,水的电离程度增大,c(H+)增大,pH<7,所以溶液显酸性 |
| C、向水中加入氨水,平衡逆向移动,水的电离受到抑制,所以c(OH-)降低 |
| D、向水中加入少量硫酸,c(H+)增大 |
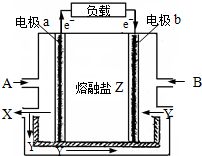 熔融碳酸盐燃料电池是以熔融的碳酸盐为电解质的燃料电池,其工作原理如图所示:
熔融碳酸盐燃料电池是以熔融的碳酸盐为电解质的燃料电池,其工作原理如图所示: 将溶液(或气体)X逐渐加入(或通入)到一定量Y溶液中,产生沉淀的质量与加入X的物质的量关系如图,符合图中情况的一组物质是( )
将溶液(或气体)X逐渐加入(或通入)到一定量Y溶液中,产生沉淀的质量与加入X的物质的量关系如图,符合图中情况的一组物质是( )