题目内容
常温下,有pH为12的NaOH溶液100mL,欲将其pH变为11,采取下列三种措施(忽略混合过程中溶液体积的变化),请回答有关问题:
(1)若用pH=10的NaOH溶液,应加入 mL.
(2)若用pH=2的盐酸,应加入 mL.
(3)若加水,应加入 mL.
(1)若用pH=10的NaOH溶液,应加入
(2)若用pH=2的盐酸,应加入
(3)若加水,应加入
考点:pH的简单计算
专题:电离平衡与溶液的pH专题
分析:(1)先根据溶液的pH计算氢氧根离子浓度,再根据c1V1+c2V2=c3(V1+V2)计算加入的氢氧化钠溶液体积;
(2)先计算混合溶液中氢氧根离子浓度,再根据c(OH-)=
;
(3)先根据溶液的pH计算氢氧根离子浓度,再根据c1V1=c2(V1+V2)计算加入的水体积.
(2)先计算混合溶液中氢氧根离子浓度,再根据c(OH-)=
| n(碱)-n(酸) |
| V(酸)+V(碱) |
(3)先根据溶液的pH计算氢氧根离子浓度,再根据c1V1=c2(V1+V2)计算加入的水体积.
解答:
解:(1)pH=12 的NaOH溶液中氢氧根离子浓度是0.01mol/L,pH=11的氢氧化钠溶液中氢氧根离子浓度是0.001mol/L,pH=10的氢氧化钠溶液中氢氧根离子浓度是0.0001mol/L,
设加入pH=10的NaOH溶液体积是V2,
c1V1+c2V2=c3(V1+V2)=0.01mol/L×0.1L+0.0001mol/L×V2=0.001mol/L(0.1+V2),
V2=1L=1000mL,
故答案为:1000;
(2)pH=2的HCl溶液中氢离子浓度是0.01mol/L,设加入盐酸的体积是V,
c(OH-)=
=
=0.001mol/L,
V=81.8mL,
故答案为:81.8;
(3)pH=12 的NaOH溶液中氢氧根离子浓度是0.01mol/L,pH=11的氢氧化钠溶液中氢氧根离子浓度是0.001mol/L,设加入水的体积是V2,c1V1=c2(V1+V2)=0.01mol/L×0.1L=(0.1+V2)L,V2=
=0.9L=900mL,
故答案为:900.
设加入pH=10的NaOH溶液体积是V2,
c1V1+c2V2=c3(V1+V2)=0.01mol/L×0.1L+0.0001mol/L×V2=0.001mol/L(0.1+V2),
V2=1L=1000mL,
故答案为:1000;
(2)pH=2的HCl溶液中氢离子浓度是0.01mol/L,设加入盐酸的体积是V,
c(OH-)=
| n(碱)-n(酸) |
| V(酸)+V(碱) |
| 0.01mol/L×(0.1-V)L |
| (0.1+V)L |
V=81.8mL,
故答案为:81.8;
(3)pH=12 的NaOH溶液中氢氧根离子浓度是0.01mol/L,pH=11的氢氧化钠溶液中氢氧根离子浓度是0.001mol/L,设加入水的体积是V2,c1V1=c2(V1+V2)=0.01mol/L×0.1L=(0.1+V2)L,V2=
| 0.01mol/L×0.1L |
| 0.001mol/L |
故答案为:900.
点评:本题考查溶液pH的简单计算,明确浓度与pH的换算、酸碱混合溶液为碱性时离子浓度的关系等是解答本题的关键,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列离子在溶液中能大量共存,加入OH-能产生白色沉淀的是( )
| A、Ag+、Na+、NO3-、I- |
| B、H+、Na+、SO42-、Cl- |
| C、K+、Mg2+、SO42-、NO3- |
| D、K+、Fe3+、NO3-、SO42- |
100mL 6mol?L-1 H2SO4跟过量锌粉反应,一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量:①Na2CO3(s) ②BaCl2(aq) ③KNO3(aq) ④CH3COONa固体 ⑤NaCl(aq),其中组合正确的是( )
| A、①②③ | B、②④⑤ |
| C、③④⑤ | D、①③④ |
下列判断合理的是( )
| A、用NaOH溶液滴定HCI与CH3COOH的混合溶液至中性时,溶液中的酸被完全中和 |
| B、0.1mol/LNa2CO3溶液35℃时的碱性比25℃时强,说明盐类水解反应是放热反应 |
| C、室温下,同浓度的Na2CO3溶液的pH比 Na2SiO3溶液的pH小,说明非金属性C>Si |
| D、焰色反应是化学变化 |
下列分子中所有原子都共平面的是( )
| A、乙烷 | B、丙烯 | C、溴苯 | D、乙醇 |
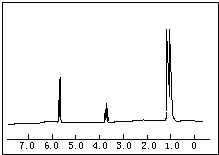 已知1-丙醇和2-丙醇的结构简式如图:
已知1-丙醇和2-丙醇的结构简式如图: