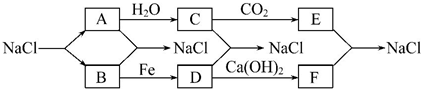
题目内容
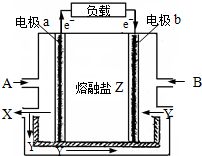 熔融碳酸盐燃料电池是以熔融的碳酸盐为电解质的燃料电池,其工作原理如图所示:
熔融碳酸盐燃料电池是以熔融的碳酸盐为电解质的燃料电池,其工作原理如图所示:(1)电极b是该燃料电池的
(2)若以氢气为燃料,则A是(填化学式)
(3)若以一氧化碳为燃料,则反应非常慢,可通过反应CO+H2O=CO2+H2,使一氧化碳转化为氢气再进一步反应.
已知25℃时,C(s)+O2(g)=CO2(g)△H=-394kJ/mol
H2(g)+
| 1 |
| 2 |
C(s)+
| 1 |
| 2 |
则25℃时,CO(g)+H2O(g)=CO2(g)+H2(g)的反应热△H=
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)在燃料电池中,电子由负极流向正极;
(2)在燃料电池中,燃料做负极,氧气作正极;电解质中的阴离子移向负极;
(3)①根据盖斯定律结合已知热化学方程式来计算反应的焓变.
(2)在燃料电池中,燃料做负极,氧气作正极;电解质中的阴离子移向负极;
(3)①根据盖斯定律结合已知热化学方程式来计算反应的焓变.
解答:
解:(1)在燃料电池中,电子由负极流行正极,根据图示内容:电子是从a流向b,可以知道电极b是该燃料电池的正极,故答案为:正;
(2)在燃料电池中,燃料做负极,氧气作正极,所以若以氢气为燃料,则A是氢气,根据:熔融碳酸盐燃料电池是以熔融的碳酸盐为电解质的燃料电池“可以知道Y是二氧化碳,在电池中,电解质中的阴离子移向负极,正极上是氧气得电子的还原反应,则正极的电极反应式为:O2+4e-+2CO2═2CO32-,
故答案为:H2;CO2;电极a;O2+4e-+2CO2═2CO32-;
(3)C(s)+O2(g)═CO2(g)△H=-394kJ/mol;H2O(g)=H2(g)+
O2(g),△H=242kJ/mol;
CO(g)=C(s)+
O2(g),△H=111kJ/mol,
反应CO(g)+H2O(g)═CO2(g)+H2(g)可以看成是以上三个反应的和,
所以反应CO(g)+H2O(g)═CO2(g)+H2(g)△H=-394kJ/mol+242kJ/mol+111kJ/mol=-41 kJ/mol,
故答案为:-41 kJ/mol.
(2)在燃料电池中,燃料做负极,氧气作正极,所以若以氢气为燃料,则A是氢气,根据:熔融碳酸盐燃料电池是以熔融的碳酸盐为电解质的燃料电池“可以知道Y是二氧化碳,在电池中,电解质中的阴离子移向负极,正极上是氧气得电子的还原反应,则正极的电极反应式为:O2+4e-+2CO2═2CO32-,
故答案为:H2;CO2;电极a;O2+4e-+2CO2═2CO32-;
(3)C(s)+O2(g)═CO2(g)△H=-394kJ/mol;H2O(g)=H2(g)+
| 1 |
| 2 |
CO(g)=C(s)+
| 1 |
| 2 |
反应CO(g)+H2O(g)═CO2(g)+H2(g)可以看成是以上三个反应的和,
所以反应CO(g)+H2O(g)═CO2(g)+H2(g)△H=-394kJ/mol+242kJ/mol+111kJ/mol=-41 kJ/mol,
故答案为:-41 kJ/mol.
点评:本题是一道综合性题目,侧重于考查原电池原理的应用、盖斯定律计算反应热,题目难度中等,侧重于对基础知识的综合应用的考查.

练习册系列答案
相关题目
下列说法正确的是( )
| A、某气体能使澄清石灰水变浑浊,则该气体是CO2 |
| B、向某溶液中加入AgNO3溶液,产生白色沉淀,则原溶液中有Cl- |
| C、向某溶液中加入Ba(NO3)2溶液,产生白色沉淀,加入稀硝酸沉淀不溶解,则原溶液中有SO42- |
| D、向某溶液中加NaOH并加热,产生可使湿润的红色石蕊试纸变蓝的气体,则原溶液中有NH4+ |
下列离子在溶液中能大量共存,加入OH-能产生白色沉淀的是( )
| A、Ag+、Na+、NO3-、I- |
| B、H+、Na+、SO42-、Cl- |
| C、K+、Mg2+、SO42-、NO3- |
| D、K+、Fe3+、NO3-、SO42- |
下列判断合理的是( )
| A、用NaOH溶液滴定HCI与CH3COOH的混合溶液至中性时,溶液中的酸被完全中和 |
| B、0.1mol/LNa2CO3溶液35℃时的碱性比25℃时强,说明盐类水解反应是放热反应 |
| C、室温下,同浓度的Na2CO3溶液的pH比 Na2SiO3溶液的pH小,说明非金属性C>Si |
| D、焰色反应是化学变化 |
25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
| A、pH=1的溶液中:Na+、K+、C2O42-、CrO42- |
| B、水电离出的c(H+)=1×10-13 mol/L的溶液中:NH4+、Na+、SO42-、NO3- |
| C、c(OH- )=0.1mol/L的溶液中:Na+、CO32-、NO3-、AlO2- |
| D、0.1mol/LFeCl3溶液中:K+、NH4+、HCO3-、SO42- |