题目内容
11.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )| A. | 9.2克甲苯含有的C-H数目为0.8NA | |
| B. | 1 mol羟基所含的电子数为7NA | |
| C. | 1 mol乙醇催化氧化生成乙醛时转移的电子数为4NA | |
| D. | 分子式为C3H6的有机物一定含有NA个碳碳双键 |
分析 A、求出甲苯的物质的量,然后根据甲苯中含8个C-H键来分析;
B、羟基中含9个电子;
C、1mol乙醇被氧化时消耗0.5mol氧气;
D、分子式为C3H6的有机物可能为丙烯,也可能为环丙烷.
解答 解:A、9.2g甲苯的物质的量为0.1mol,而甲苯中含8个C-H键,故0.1mol甲苯中含0.8NA条C-H键,故A正确;
B、羟基中含9个电子,故1mol羟基中含9NA个电子,故B错误;
C、1mol乙醇被氧化时消耗0.5mol氧气,而氧元素由0价变为-2价,故0.5mol氧气参与反应后转移2mol电子即2NA个,故C错误;
D、分子式为C3H6的有机物可能为丙烯,也可能为环丙烷,故结构中不一定含碳碳双键,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
1.如表列出了A~M13种元素在周期表中的位置:
(1)这些元素中,金属性最强的元素是钾(填元素名称),非金属性最强的元素是氟(填元素名称),最不活泼的元素是Ar(填元素符号),原子半径最小的元素是H(填元素符号).
(2)写出C元素的气态氢化物与I元素的最高价氧化物的水化物反应的化学方程式:2NH3+H2SO4═(NH4)2SO4.
(3)将C、D、E三种元素的氢化物按还原性增强的顺序排列为HF<H2O<NH3(用化学式表示).
(4)A与D形成的化合物A2D2是共价化合物(填“共价”或“离子”),其电子式为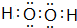 .该物质可将碱性工业废水中的CNˉ氧化为碳酸盐和氨,相应的离子方程式为H2O2+CN-+OH-═CO32-+NH3↑.
.该物质可将碱性工业废水中的CNˉ氧化为碳酸盐和氨,相应的离子方程式为H2O2+CN-+OH-═CO32-+NH3↑.
| 周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅤⅠA | ⅤⅡA | 0 |
| 1 | A | |||||||
| 2 | B | C | D | E | ||||
| 3 | F | G | H | I | J | K | ||
| 4 | L | M |
(2)写出C元素的气态氢化物与I元素的最高价氧化物的水化物反应的化学方程式:2NH3+H2SO4═(NH4)2SO4.
(3)将C、D、E三种元素的氢化物按还原性增强的顺序排列为HF<H2O<NH3(用化学式表示).
(4)A与D形成的化合物A2D2是共价化合物(填“共价”或“离子”),其电子式为
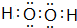 .该物质可将碱性工业废水中的CNˉ氧化为碳酸盐和氨,相应的离子方程式为H2O2+CN-+OH-═CO32-+NH3↑.
.该物质可将碱性工业废水中的CNˉ氧化为碳酸盐和氨,相应的离子方程式为H2O2+CN-+OH-═CO32-+NH3↑.
2.在一定温度下,向a L恒容的密闭容器中,加入1mol X气体和2mol Y气体,发生如下反应:X(g)+2Y(g)?2Z(g),此反应达到平衡的标志是( )
| A. | X、Y、Z三种物质体积分数均相等 | |
| B. | 容器内X、Y、Z的浓度不随时间变化 | |
| C. | 容器内气体的密度不再变化 | |
| D. | 单位时间消耗0.2 molY同时生成0.2molZ |
19.下列有关性质的比较,不能用元素周期律解释的是( )
| A. | 酸性:H2SO4>H3PO4 | B. | 非金属性:Cl>Br | ||
| C. | 碱性:热稳定性:Na2CO3>NaHCO3 | D. | NaOH>Mg(OH)2 |
6.分子中有3个-CH3的C7H16其可能的结构有( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
16.下列有关实验正确的是( )
| A. | 甲烷中混有的乙烯可通过酸性高锰酸钾溶液来除去 | |
| B. | 除去乙酸乙酯中的乙酸,先加入饱和Na2CO3溶液再分液 | |
| C. | 加稀硫酸的淀粉水解实验的溶液中,加入新制的氢氧化铜并加热以确定水解产物葡萄糖 | |
| D. | 用水能鉴别乙醇、甘油和四氯化碳 |
20.属于同分异构体的是( )
| A. | O2和O3 | B. | 2H2和3H2 | ||
| C. | H2O与H2O2 | D. | CH3CH2COOH与CH3COOCH3 |
1.下列物质中,具有漂白作用的是( )
| A. | 活性炭 | B. | 新制氯水 | C. | 次氯酸溶液 | D. | 二氧化硫 |