题目内容
7. 硝酸越稀还原产物中氮元素的化合价越低.某同学取铁铝合金与足量很稀的硝酸充分反应没有气体放出.在反应后的溶液中逐渐加入4mol•L-1NaOH溶液,所加NaOH溶液的体积与产生的沉淀的物质的量的关系如图所示(不考虑沉淀的微量溶解).下列说法正确的是( )
硝酸越稀还原产物中氮元素的化合价越低.某同学取铁铝合金与足量很稀的硝酸充分反应没有气体放出.在反应后的溶液中逐渐加入4mol•L-1NaOH溶液,所加NaOH溶液的体积与产生的沉淀的物质的量的关系如图所示(不考虑沉淀的微量溶解).下列说法正确的是( )| A. | D点溶液中存在:c(NH4+)+c(Na+)+c(H+)═c(OH-)+c(NO3-) | |
| B. | EF段发生反应的离子方程式为:Al(OH)3+OH-═AlO2-+2H2O | |
| C. | D点溶液中n(NH4+)=0.012mol | |
| D. | 由水电离产生的c(H+):O点>F点 |
分析 铁铝合金与足量很稀HNO3充分反应,被氧化为Al3+、Fe3+,通过题意,反应始终没有气体生成,可以得出不会有氮的氧化物生成,由于硝酸的浓度越稀,对应还原产物中氮元素的化合价越低,可以推测N元素由+5变成了-3价,由图可得硝酸过量,加入氢氧化钠溶液应先与硝酸反应,再生成沉淀,当沉淀完全后,由图知继续加入氢氧化钠溶液,沉淀量不变,可得与NH4+发生了反应,则随着NaOH的滴加,发生的反应依次有:
①H++OH-=H2O,②Fe3++3OH-=Fe(OH)3↓,Al3++3OH-=Al(OH)3↓,③NH4++OH-═NH3•H2O,④Al(OH)3 +OH-=AlO2-+2H2O,
A.D点溶液溶质为硝酸铵和硝酸钠;
B.EF段为氢氧化铝溶解在氢氧化钠中;
C.根据DE段消耗氢氧化钠的体积,结合发生反应计算溶液中n(NH4+);
D.O点是酸过量对水的电离起抑制作用,而F是偏铝酸钠和硝酸钠的混合溶液,偏铝酸根离子对水的电离起促进作用.
解答 解:铁铝合金与足量很稀HNO3充分反应,被氧化为Al3+、Fe3+,通过题意,反应始终没有气体生成,可以得出不会有氮的氧化物生成,由于硝酸的浓度越稀,对应还原产物中氮元素的化合价越低,可以推测N元素由+5变成了-3价,由图可得硝酸过量,加入氢氧化钠溶液应先与硝酸反应,再生成沉淀,当沉淀完全后,由图知继续加入氢氧化钠溶液,沉淀量不变,可得与NH4+发生了反应,则随着NaOH的滴加,发生的反应依次有:
①H++OH-=H2O,②Fe3++3OH-=Fe(OH)3↓,Al3++3OH-=Al(OH)3↓,③NH4++OH-═NH3•H2O,④Al(OH)3 +OH-=AlO2-+2H2O,
A.D点溶液溶质为硝酸铵和硝酸钠,由电荷守恒可知应为c(NH4+)+c(Na+)+c(H+)=c(OH-)+c(NO3-),故A正确;
B.EF段为氢氧化铝溶解在氢氧化钠中,反应为Al(OH)3+OH-═AlO2-+2H2O,故B正确;
C.由图可知DE段消耗氢氧化钠的体积为3mol,由NH4++OH-═NH3•H2O可知溶液中n(NH4+)=n(OH-)=0.003L×4mol/L=0.012mol,故C正确;
D.O点是酸过量对水的电离起抑制作用,而F是偏铝酸钠和硝酸钠的混合溶液,偏铝酸根离子对水的电离起促进作用,所以由水电离产生的c(H+):O点<F点,故D错误.
故选D.
点评 本题考查较为综合,涉及金属与硝酸的反应、离子方程式的书写、氧化还原反应、化学计算等知识点,属于中等难度试题.解答此题关键是判断出硝酸的还原产物以及电子转移守恒的运用.

①高级脂肪酸与甘油脱水形成油脂 ②乙醇在浓H2SO4作用下脱水制乙烯
③氨基酸在酶的作用下脱水形成二肽 ④葡萄糖在浓H2SO4作用下脱水成焦炭.
| A. | ①② | B. | ①③ | C. | ②③ | D. | ②④ |
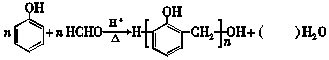
下列说法正确的是( )
| A. | 方程式中水的化学计量数是 2n-1 | |
| B. | 常温下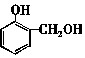 比 比 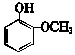 更难溶于水 更难溶于水 | |
| C. | 1 mol HCHO与银氨溶液反应最多可以生成2 mol Ag | |
| D. |  的单体是 的单体是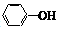 和HCHO 和HCHO |
| 物质 | 性质 | 用途 | |
| A | Fe2O3 | 红棕色粉末 | 常用作红色油漆和颜料 |
| B | NaHCO3 | 溶液呈碱性 | 可用作食用碱或工业用碱 |
| C | Si | 导电性介于道题与绝缘体之间 | 用于制作计算机芯片、光电池 |
| D | SO2 | 还原性 | 工业上用来漂白纸浆、毛、丝、草帽辫等 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 含NA个Na+的NaOH溶于1L水中形成溶液的物质的量浓度为lmol•L-1 | |
| B. | 总质量为18g的H216O和H218O所含分子数为NA | |
| C. | 常温常压下,22.4L的CO2与Mg完全反应,转移电子数为4NA | |
| D. | 硫酸的摩尔质量与NA个硫酸分子的质量在数值上相等 |
| 实验操作 | 实验现象 | 结论 | |
| A | 将SO2通人溴水中 | 溴水颜色褪去 | SO2具有漂白性 |
| B | 将铁屑放入稀HNO3中 | 放出无色气体 | Fe比H2活泼 |
| C | 将澄清石灰水滴入某溶液 | 生成白色沉淀 | 溶液中存CO32- |
| D | 将乙烯通入KMnO4酸性溶液 | KMnO4颜色褪去 | 乙烯具有还原性 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 面包 | B. | 米饭 | C. | 牛肉 | D. | 蔬菜 |
 纯铜在工业上主要用来制造导线、电器元件等,铜能形成+1和+2的化合物.回答下列问题:
纯铜在工业上主要用来制造导线、电器元件等,铜能形成+1和+2的化合物.回答下列问题:


