题目内容
足量铜与一定量浓硝酸反应得到Cu(NO3)2溶液和NO2、NO的混合气体,这些气体与1.68L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸.若向所得Cu(NO3)2溶液中加入5mol?L-1 NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
| A、60 mL |
| B、45 mL |
| C、30 mL |
| D、15 mL |
考点:化学方程式的有关计算
专题:计算题
分析:铜和硝酸反应生成NO2、NO的混合气体,铜失去电子数等于N元素得到电子数,将这些气体与1.68L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸,则这些气体失去电子数等于氧气得到电子数,所以铜失去电子数等于氧气得到电子数,再结合铜离子和氢氧化钠反应方程式计算氢氧化钠体积.
解答:
解:铜和硝酸反应生成NO2、NO的混合气体,铜失去电子数等于N元素得到电子数,将这些气体与1.68L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸,则这些气体失去电子数等于氧气得到电子数,则n(Cu)=
=0.15mol,根据铜原子守恒得n(Cu)=n(Cu(NO3)2)=0.15mol,
硝酸铜和NaOH反应关系式为:Cu(NO3)2----2NaOH,则消耗V(NaOH)=
=
=
=0.06L=60mL,
故选A.
| ||
| 2 |
硝酸铜和NaOH反应关系式为:Cu(NO3)2----2NaOH,则消耗V(NaOH)=
| n(NaOH) |
| C(NaOH) |
| 2n[Cu(NO3)2] |
| C(NaOH) |
| 2×0.15mol |
| 5mol/L |
故选A.
点评:本题考查了根据方程式的计算,涉及氧化还原反应、复分解反应,根据转移电子相等计算铜的物质的量,再根据关系式计算氢氧化钠体积,明确铜失去电子的物质的量与氧气得到电子的物质的量相等是解本题关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列各组物质中,分子数相同的是( )
| A、2L SO2和2L CO2 |
| B、0.5mol水和标准状况下11.2L CO2 |
| C、标准状况下1mol氧气和22.4L水 |
| D、0.2mol硫化氢气体和2.24 L氯化氢气体 |
电浮选凝聚法是工业上采用的一种污水处理方法,某研究小组用电浮选凝聚法处理污水,设计装置如图所示,下列说法正确的是( )
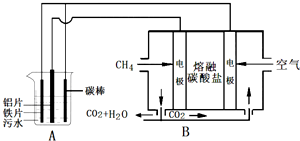

| A、装置A中碳棒为阴极 |
| B、装置B中通入空气的电极反应是O2+2H2O+4e-═4OH- |
| C、污水中加入适量的硫酸钠,既可增强溶液的导电性,又可增强凝聚净化的效果 |
| D、标准状况下,若A装置中产生44.8L气体,则理论上B装置中要消耗CH4 11.2L |
盐酸、醋酸和碳酸氢钠是生活中常见的物质.下列表述正确的是( )
| A、在NaHCO3溶液中加入与其等物质的量的NaOH,溶液中的阴离子只有CO32-和OH- |
| B、NaHCO3溶液中:c(H+)+c(H2CO3)=c(OH-) |
| C、10mL 0.20mol?L-1 CH3COOH溶液加入10mL 0.10mol?L-1的NaOH后,溶液中:c(CH3COO-)+c(CH3COOH)=0.10mol?L-1 |
| D、中和体积与pH都相同的HCl溶液和CH3COOH溶液所消耗的NaOH物质的量相同 |
欲检验某无色溶液中是否含有SO42-,为了防止Ag+、CO32-、SO32-等离子的干扰,下列实验方案比较严密的是( )
| A、先加稀盐酸将溶液酸化,再滴加氯化钡溶液,看是否生成白色沉淀 |
| B、先加稀硝酸将溶液酸化,再滴加氯化钡溶液,看是否生成白色沉淀 |
| C、直接向溶液中滴加稀硝酸酸化过的氯化钡溶液,看是否生成白色沉淀 |
| D、直接向溶液中滴加稀盐酸酸化过的氯化钡溶液,看是否生成白色沉淀 |
下列反应的离子方程式书写正确的是( )
| A、铝与氢氧化钠溶液反应:Al+4OH-═[Al(OH)4]-+H2↑ |
| B、氯化铝溶液中加入过量的氨水:Al3++4NH3?H2O═[Al(OH)4]-+4NH4+ |
| C、氯化铁溶液中加入铜粉:Fe3++Cu═Cu2++Fe2+ |
| D、氯化铜溶液中加入锌粉:Cu2++Zn═Cu+Zn2+ |
下列各物质:①3.01×1023个CH4②标况44.8L C02③17gNH3的物质的量由多到少的顺序是( )
| A、②③① | B、②①③ |
| C、①②③ | D、③②① |
下列有机物的命名肯定错误的是( )
| A、3-甲基-2-戊烯 |
| B、2-甲基-2-丁烯 |
| C、2,2-二甲基丙烷 |
| D、2-甲基-3-丁炔 |