题目内容
5.按要求写出下列化学方程式:(1)2-丁烯与溴水反应:CH3-CH=CH-CH3+Br2→CH3-CHBr-CHBr-CH3;
(2)实验室制取乙炔:CaC2+2H2O→Ca(OH)2+CH≡CH↑;;
(3)甲苯制取“TNT”炸药:
 .
.
分析 (1)2-丁烯中含有碳碳双键,和溴单质加成反应生成2,3-二溴丁烷;
(2)碳化钙与水反应生成乙炔气体和氢氧化钙;
(3)甲苯与浓硝酸发生取代反应可生成TNT,即三硝基甲苯.
解答 解:(1)2-丁烯中含有碳碳双键,2-丁烯和溴单质加成反应生成2,3-二溴丁烷,反应方程式为:CH3-CH=CH-CH3+Br2→CH3-CHBr-CHBr-CH3,
故答案为:CH3-CH=CH-CH3+Br2→CH3-CHBr-CHBr-CH3;
(2)实验室中用碳化钙与水发生水解反应,生成乙炔,反应的化学方程式为:CaC2+2H2O→Ca(OH)2+CH≡CH↑,
故答案为:CaC2+2H2O→Ca(OH)2+CH≡CH↑;
(3)甲苯可以和浓硝酸之间发生取代反应生成2,4,6-三硝基甲苯,即TNT,化学反应方程式为 ,
,
故答案为: .
.
点评 本题考查有机化学反应方程式的书写,为高频考点,把握发生的化学反应及官能团与性质的关系为解答的关键,注意有机反应条件及反应类型,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
16.下列溶液中NO3-的物质的量浓度最大的是( )
| A. | 500 mL 1 mol•L-1的KNO3溶液 | |
| B. | 500 mL 1 mol•L-1的Ba(NO3)2溶液 | |
| C. | 1000 mL 0.5 mol•L-1的Mg(NO3)2溶液 | |
| D. | 1000 mL 0.5 mol•L-1的Fe(NO3)3溶液 |
13.下列说法正确的是( )
| A. | 绿色食品就是指颜色为绿色的食品 | B. | 有机食品是指含有机物的食品 | ||
| C. | OTC表示处方药 | D. | 加碘盐是在食盐中加入KIO3 |
20.下列过程中,有电能转化为化学能的是( )
| A. | 打手机 | B. | 光合作用 | C. | 电解水 | D. | 点燃氢气 |
10.某自来水中含有Ca2+、Mg2+、Na+、K+、HCO3-、SO42-、Cl-,长期烧煮上述自来水会在锅炉内形成水垢.锅炉水垢不仅耗费燃料,而且有烧坏锅炉的危险,因此要定期清除锅炉水垢.已知部分物质20℃时的溶解度数据为
(1)请用化学方程式表示锅炉中的水垢含有Mg(OH)2的原因:Mg(HCO3)2$\frac{\underline{\;\;△\;\;}}{\;}$MgCO3↓+H2O+CO2↑,MgCO3+H2O$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2+CO2↑.
(2)锅炉中的水垢所含有的CaSO4不能直接用酸除去,需要加入试剂X,使其转化为易溶于盐酸的物质Y而除去.试剂X是C(填序号).
A、食醋 B、氯化钡 C、碳酸钠 D碳酸氢钠
CaSO4能转化为物质Y 的原因是(用文字叙述)碳酸钙的溶解度小于硫酸钙的溶解度.
(3)除含CaSO4、Mg(OH)2外,锅炉水垢中还可能含有的物质是(写化学式)MgCO3和CaCO3.
(4)水中的Ca2+、Mg2+可以用一定浓度的M溶液进行测定,M与Ca2+、Mg2+都以等物质的量进行反应.现取含Ca2+浓度为0.40g/L的自来水样10mL,至锥形瓶中进行滴定,达到终点时,用去了浓度为0.01mol/L的M溶液20.00mL,则该自来水样中Mg2+的物质的量浓度是0.01mol/L.
| 物质 | Mg(OH)2 | CaCO3 | MgCO3 | Ca(OH)2 | CaSO4 | MgSO4 |
| $\frac{溶解度}{g/100g{H}_{2}O}$ | 9.0×10-4 | 1.5×10-3 | 1.0×10-2 | 1.7×10-1 | 2.1×10-1 | 26.7 |
(2)锅炉中的水垢所含有的CaSO4不能直接用酸除去,需要加入试剂X,使其转化为易溶于盐酸的物质Y而除去.试剂X是C(填序号).
A、食醋 B、氯化钡 C、碳酸钠 D碳酸氢钠
CaSO4能转化为物质Y 的原因是(用文字叙述)碳酸钙的溶解度小于硫酸钙的溶解度.
(3)除含CaSO4、Mg(OH)2外,锅炉水垢中还可能含有的物质是(写化学式)MgCO3和CaCO3.
(4)水中的Ca2+、Mg2+可以用一定浓度的M溶液进行测定,M与Ca2+、Mg2+都以等物质的量进行反应.现取含Ca2+浓度为0.40g/L的自来水样10mL,至锥形瓶中进行滴定,达到终点时,用去了浓度为0.01mol/L的M溶液20.00mL,则该自来水样中Mg2+的物质的量浓度是0.01mol/L.
14. (1)已知:在常温下,浓度均为0.1mol•L-1的下列六种溶液的pH:
(1)已知:在常温下,浓度均为0.1mol•L-1的下列六种溶液的pH:
复分解反应存在这样一个规律:一种较强酸(或碱性较强的物质)可以自发地反应生成较弱酸(或碱性较弱的物质).照该规律,请判断下列反应不能成立的是CD (填编号).
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2NaClO=Na2CO3+2HClO D.CO2+H2O+2C6H5ONa=Na2CO3+2C6H5OH
(2)根据前述信息判断,浓度均为0.05mol•L-1的下列六种物质的溶液中,pH最小的是⑤ (填编号);将各溶液分别稀释100倍,pH变化最小的是① (填编号).
①C6H5OH ②CH3COOH ③HCN ④HClO ⑤H2SO4 ⑥HClO4
(3)根据前述信息,写出将过量的氯气通入到少量的碳酸钠溶液中反应的离子方程式:Cl2+H2O+2CO32-=2HCO3-+Cl-+ClO-.
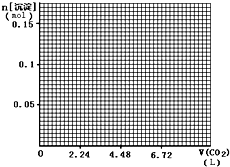
(4)标准状况下,向1L含NaOH、Ca(OH)2各0.1mol的溶液中不断通入CO2至过量,请画出产生的沉淀的物质的量(mol)随CO2通入体积(L)的变化趋势图.
 (1)已知:在常温下,浓度均为0.1mol•L-1的下列六种溶液的pH:
(1)已知:在常温下,浓度均为0.1mol•L-1的下列六种溶液的pH:| 溶质 | CH3CO ONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2NaClO=Na2CO3+2HClO D.CO2+H2O+2C6H5ONa=Na2CO3+2C6H5OH
(2)根据前述信息判断,浓度均为0.05mol•L-1的下列六种物质的溶液中,pH最小的是⑤ (填编号);将各溶液分别稀释100倍,pH变化最小的是① (填编号).
①C6H5OH ②CH3COOH ③HCN ④HClO ⑤H2SO4 ⑥HClO4
(3)根据前述信息,写出将过量的氯气通入到少量的碳酸钠溶液中反应的离子方程式:Cl2+H2O+2CO32-=2HCO3-+Cl-+ClO-.
(4)标准状况下,向1L含NaOH、Ca(OH)2各0.1mol的溶液中不断通入CO2至过量,请画出产生的沉淀的物质的量(mol)随CO2通入体积(L)的变化趋势图.
15.在密闭容器中进行反应:A(g)+2B(g)?3C(g)+D(s),有关下列图象的说法不正确的是( )
| A. | 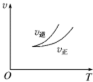 依据图可判断正反应为放热反应 | |
| B. | 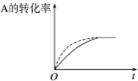 在图中,虚线可表示压缩反应装置体积的情况 | |
| C. | 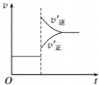 若正反应的△H>0,图可表示升高温度使平衡向逆反应方向移动 | |
| D. | 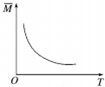 由图中混合气体的平均相对分子质量随温度的变化情况,可推知逆反应的△H<0 |
 化学在能源开发与利用中起着十分重要的作用.
化学在能源开发与利用中起着十分重要的作用.