题目内容
1.乙二酸(HOOC-COOH)俗名草酸,易溶于水,属于二元中强酸,在生产和科学实验中有着广泛的用途.草酸晶体的组成可用H2C2O4•xH2O表示,为了测定x值,进行如下实验:称取Wg草酸晶体,配成100.00mL水溶液,量取25.00mL所配制的草酸溶液置于锥形瓶内,加入适量稀H2SO4后,用浓度为amol•L-1的KMnO4溶液滴定,已知所发生的反应方程式如下:
2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O
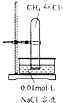
(1)整个实验过程中一定不需要的仪器有(填序号)f、j,还缺少的仪器有(填名称)胶头滴管、滴定管夹.
a.托盘天平(带砝码,镊子) b.滴定管 c.100mL量筒 d.100mL容量瓶 e.烧杯
f.漏斗 g.锥形瓶 h.玻璃棒 i.药匙 j.烧瓶 k 铁架台
(2)实验中,标准KMnO4溶液应盛装在酸式滴定管中,
判断滴定终点的标准是滴入最后一滴KMnO4溶液,溶液由无色变为浅紫色且半分钟不褪色.
(3)若在定容时视线偏高,则所测得的x值会偏小(偏大、偏小、无影响).
(4)在滴定过程中若用去amol•L-1的KMnO4溶液VmL,则所配制的草酸溶液的物质的量浓度为0.1aVmol•L-1,由此可计算x的值是$\frac{50W}{9aV}$-5.
分析 (1)配制溶液和滴定过程中,不需要漏斗、烧瓶,缺少胶头滴管、滴定管夹;
(2)因高锰酸钾具有强氧化性,应装在酸式滴定管中;滴入最后一滴KMnO4溶液,溶液由无色变为浅紫色且半分钟不褪色;
(3)定容时视线偏高,加蒸馏水过多,使草酸浓度偏低,所测得的结果偏低;
(4)根据化学方程式中各物质的关系进行计算出草酸的浓度,从而计算出样品中含有草酸的质量、结晶水的质量,最后计算出草酸晶体中x值.
解答 解:(1)配制溶液和滴定过程中,不需要漏斗、烧瓶,缺少胶头滴管、滴定管夹,
故答案为:f、j;胶头滴管、滴定管夹;
(2)高锰酸钾具有强氧化性,会腐蚀碱式滴定管的橡胶,应装在酸式滴定管中,根据KMnO4溶液呈紫色,草酸反应完毕,滴入最后一滴KMnO4溶液,紫色不褪去,说明滴定到终点,不需要外加指示剂,
故答案为:酸式;滴入最后一滴KMnO4溶液,溶液由无色变为浅紫色且半分钟不褪色
(3)定容时视线偏高,加蒸馏水过多,使草酸浓度偏低,所测得的结果偏低,
故答案为:偏低;
(4)2KMnO4~5H2C2O4
2 5
aV×10-3 mol 0.025×c mol
c=$\frac{5aV×1{0}^{-3}mol}{2×0.025mol}$=0.1aVmol•L-1,
样品中含有草酸的质量为:90g/mol×0.1aVmol/L×0.025L×4=0.9aVg,Wg草酸晶体中含有结晶水的质量为:Wg-0.9aVg,
在H2C2O4•xH2O中,H2C2O4与水的物质的量之比为:$\frac{n({H}_{2}{C}_{2}{O}_{4})}{n({H}_{2}O)}$=$\frac{1}{x}$,
草酸晶体中含有结晶水数目为:x=$\frac{Wg-0.9aVg}{18g•mo{l}^{-1}}$÷$\frac{0.9aVg}{90g•mo{l}^{-1}}$=$\frac{50W}{9aV}$-5,
故答案为:0.1aV;$\frac{50W}{9aV}$-5.
点评 该题涉及到氧化还原滴定,虽然基于反应原理与中和滴定不同,但实验原理及操作和所用仪器等类似.由于该反应有明显的颜色变化,故可不可用指示剂.注意滴定中经常根据关系式进行计算,掌握根据关系式计算方法.

| A. | 0.1 mol/L NaHCO3溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) | |
| B. | 20 mL 0.1 mol/L CH3COONa溶液与10 mL 0.1 mol/L HCl溶液混合后溶液呈酸性,所得溶液中c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| C. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH4+)+c(OH-) | |
| D. | 0.1 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
| A. | 将水库的钢闸门与电源负极相连或将锌块焊接于闸门上以防止其生锈 | |
| B. | 用于文物年代鉴定的放射性14C和作为原子量标准的12C,化学性质不同 | |
| C. | 苯酚、甲醛分别可用于环境消毒和鱼肉等食品的防腐保鲜 | |
| D. | NO2和SO2都是酸性氧化物,都是大气污染物 |
| A | B | C | D | |
| 装置 | 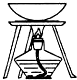 |  |  | 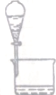 |
| 实验 | 从KI和I2的固体混合物中回收I2 | 分离混合体系中的Fe(OH)3沉淀和胶体 | 蒸干NH4Cl饱和溶液制备NH4Cl晶体 | 分离苯酚和水的混合物 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 在蒸发结晶操作中,用酒精灯加热直至溶液完全蒸干才停止加热 | |
| B. | 配制一定物质的量浓度溶液时,容量瓶必须事先干燥 | |
| C. | 用量筒取用5.0ml液体时,俯视刻度线,会使所取液体体积大于5.0ml | |
| D. | 铁氰化钾可用于Fe2+的检验 |