题目内容
某密闭容器中发生如下反应:X(g)+3Y(g)?2Z(g)△H<0.下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是( )
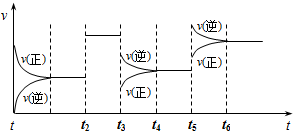

| A、t2时加入了催化剂 |
| B、t3时降低了温度 |
| C、t5时增大了压强 |
| D、该反应最初是从逆反应开始的 |
考点:化学反应速率变化曲线及其应用
专题:化学反应速率专题
分析:A.由图可知,t2时改变条件,正逆反应速率增大且相等;
B.t3时改变条件,正逆反应速率均减小,且逆反应速率大于正反应速率;
C.t5时改变条件,正逆反应速率增大,且逆反应速率大于正反应速率;
D.从图中看出起始时正反应速率不为0,逆反应速率为0.
B.t3时改变条件,正逆反应速率均减小,且逆反应速率大于正反应速率;
C.t5时改变条件,正逆反应速率增大,且逆反应速率大于正反应速率;
D.从图中看出起始时正反应速率不为0,逆反应速率为0.
解答:
解:A.由图可知,t2时改变条件,正逆反应速率增大且相等,若增大压强平衡发生移动,则t2时加入了催化剂,故A正确;
B.t3时改变条件,正逆反应速率均减小,且逆反应速率大于正反应速率,若降低温度,平衡正向移动,与图象不符,故B错误;
C.t5时改变条件,正逆反应速率增大,且逆反应速率大于正反应速率,若增大压强,平衡逆向移动,与图象不符,故C错误;
D.起始时正反应速率不为0,逆反应速率为0,该反应最初是从正反应开始的,故D错误.
故选A.
B.t3时改变条件,正逆反应速率均减小,且逆反应速率大于正反应速率,若降低温度,平衡正向移动,与图象不符,故B错误;
C.t5时改变条件,正逆反应速率增大,且逆反应速率大于正反应速率,若增大压强,平衡逆向移动,与图象不符,故C错误;
D.起始时正反应速率不为0,逆反应速率为0,该反应最初是从正反应开始的,故D错误.
故选A.
点评:本题考查化学反应速率的影响因素及图象,明确反应为放热反应且为体积缩小的反应结合平衡移动与速率大小的关系即可解答,题目难度中等.

练习册系列答案
相关题目
对于反应A+B=C,下列条件的改变一定使化学反应速率加快的是( )
| A、升高体系的温度 |
| B、增加体系的压强 |
| C、减少C的物质的量 |
| D、增加A的物质的量 |
下列说法错误的是( )
| A、升高温度可使吸热反应的反应速率增大,使放热反应的反应速率减小 |
| B、决定化学反应速率的主要因素是参加反应的物质的性质 |
| C、对于有气体参加的反应,增大体系的压强,反应速度不一定加快 |
| D、催化剂能降低反应的活化能来提高化学反应速率 |
下列根据反应原理设计的应用,不正确的是( )
| A、CO32-+H2O?HCO3-+OH-;用热的纯碱溶液清洗油污 |
| B、Al3++3H2O?Al(OH)3(胶体)+3H+;明矾净水 |
| C、TiCl4+(x+2)H2O(过量)?TiO2?xH2O↓+4HCl;制备TiO2纳米粉 |
| D、SnCl2+H2O?Sn(OH)Cl↓+HCl;配制氯化亚锡溶液时加入氢氧化钠 |
利用如图装置可实现在铜片上镀镍,下列有关说法不正确的是( )


| A、甲池是燃料电池、乙池是电镀池 |
| B、b为负极,d极为铜片 |
| C、b极上发生的电极反应为:CH4+10OH--8e-=CO32-+7H2O |
| D、c极上发生的电极反应为:Ni-2e-=Ni2+ |
下列反应中属于氧化还原反应的是( )
①2KMnO4
K2MnO4+MnO2+O2↑
②H2SO4+BaCl2═BaSO4↓+2HCl
③Zn+2HCl═ZnCl2+H2↑
④Cu2(OH)2CO3
2CuO+CO2↑+H2O.
①2KMnO4
| ||
②H2SO4+BaCl2═BaSO4↓+2HCl
③Zn+2HCl═ZnCl2+H2↑
④Cu2(OH)2CO3
| ||
| A、①② | B、②④ | C、①③ | D、③④ |
5.6g铁粉投入到盛有100mL 2mol/L稀硫酸的烧杯中,2min时铁粉刚好溶解(溶解前后溶液体积变化忽略不计),下列表示这个反应的速率正确的是( )
| A、v(Fe)=0.05 mol/(L?min) |
| B、v(H2SO4)=0.1 mol/(L?min) |
| C、v(H2SO4)=0.5 mol/(L?min) |
| D、v(FeSO4)=0.1 mol/(L?min) |