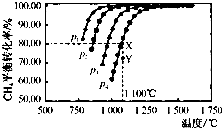
题目内容
19.下列有关叙述正确的是( )| A. | 电解饱和食盐水时,阴极的电极反应式为 2Cl--2e-═Cl2↑ | |
| B. | 放电时,铅蓄电池中硫酸浓度不断减小 | |
| C. | 氢氧燃料电池中,当电路上有1mol 电子通过时,则正极上消耗氧气为5.6L | |
| D. | 以锌片、铜片、稀硫酸组成原电池,当溶液中通过0.2mol电子时,负极减轻6.5g |
分析 A、电解饱和食盐水时,阴极上是氢离子得电子的还原反应;
B、放电时,铅蓄电池的总反应是Pb+PbO2+2H2SO4=PbSO4↓+2H2O,据此回答;
C、氢氧燃料电池中,正极上是氧气得电子的还原反应,负极上是氢气失电子的氧化反应;
D、锌片、铜片、稀硫酸组成原电池,负极上是金属锌失电子的氧化反应,电子不会经过电解质,只能走导线.
解答 解:A、电解饱和食盐水时,阴极上是氢离子得电子的还原反应,电极反应式为2H++2e-═H2↑,故A错误;
B、放电时,铅蓄电池的总反应是Pb+PbO2+2H2SO4=PbSO4↓+2H2O,消耗硫酸,所以硫酸浓度不断减小,故B正确;
C、氢氧燃料电池中,如:酸性燃料电池,正极上是氧气得电子的还原反应,O2+4e-+4H+=2H2O,负极上是氢气失电子的氧化反应2H2-4e-═4H+,当电路上有1mol 电子通过时,则正极上消耗氧气为0.25mol,在标况下的体积是5.6L,碱性条件下也是如此,5.6L是标况下的体积,故C错误;
D、锌片、铜片、稀硫酸组成原电池,负极上是金属锌失电子的氧化反应Zn-2e-=Zn2+,当转移0.2mol电子时,消耗金属锌是6.5g,但是电子不会经过电解质,只能走导线,故D错误.
故选B.
点评 本题考查原电池和电解池的工作原理以及电极反应式的书写和电子转移的计算知识,属于综合知识的迁移应用是关键,注意电子不会经过电解质,只能走导线是易错点.

练习册系列答案
相关题目
9.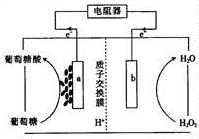 酶生物电池通常以葡萄糖作为反应原料,葡萄糖在葡萄糖氧化酶(GOX)和辅酶的作用下被氧化成葡萄糖酸(C6H1207),其工作原理如图所示.下列有关说法中正确的是( )
酶生物电池通常以葡萄糖作为反应原料,葡萄糖在葡萄糖氧化酶(GOX)和辅酶的作用下被氧化成葡萄糖酸(C6H1207),其工作原理如图所示.下列有关说法中正确的是( )
 酶生物电池通常以葡萄糖作为反应原料,葡萄糖在葡萄糖氧化酶(GOX)和辅酶的作用下被氧化成葡萄糖酸(C6H1207),其工作原理如图所示.下列有关说法中正确的是( )
酶生物电池通常以葡萄糖作为反应原料,葡萄糖在葡萄糖氧化酶(GOX)和辅酶的作用下被氧化成葡萄糖酸(C6H1207),其工作原理如图所示.下列有关说法中正确的是( )| A. | 该电池可以在高温条件下使用 | |
| B. | H+通过交换膜从b极区移向a极区 | |
| C. | 电极a是正极 | |
| D. | 电池负极的电极反应式为C6H1206+H20-2e一═C6H1207+2H+ |
14.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.高铁电池的总反应为3Zn+2K2FeO4+8H2O$?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述正确的是( )
| A. | 充电时阳极反应为Zn-2e-+2OH-═Zn(OH)2 | |
| B. | 充电时OH-向阳极移动 | |
| C. | 放电时每转移3mole-正极有1molK2FeO4被氧化 | |
| D. | 充电时,电源的正极应与电池的Zn(OH)2极相连 |
4.一种新型燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极上通乙烷和氧气,其电极反应式为:C2H6+18OH--14e-═2CO32-+12H2O,2H2O+O2+4e-═4OH-,有关此电池的推断正确的是( )
| A. | 电解质溶液中电子向正极移动 | |
| B. | 放电一段时间后,KOH的物质的量浓度不变 | |
| C. | 通乙烷的电极为负极 | |
| D. | 参加反应的O2和C2H6的物质的量之比为2:7 |
8.在酸性溶液中,下列物质氧化KI时,自身发生如下变化:IO3-→I2;MnO4-→Mn2+;Cl2→Cl-;HNO3→NO.如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是( )
| A. | IO3- | B. | MnO4- | C. | Cl2 | D. | HNO3 |
9.研究反应物的化学计量数与产物之间的关系时,使用类似数轴的方法可以收到的直观形象的效果.下列表达不正确的是( )
| A. | 密闭容器中CuO和C高温反应的气体产物: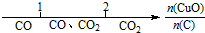 | |
| B. | Na2O2和等物质的量的CO2、H2O(g):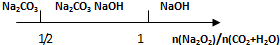 | |
| C. | NaOH溶液中通入一定量的CO2的产物: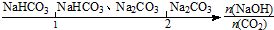 | |
| D. | AlCl3溶液中滴加NaOH溶液后体系中铝元素的存在形式: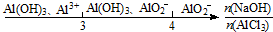 |