题目内容
4.一种新型燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极上通乙烷和氧气,其电极反应式为:C2H6+18OH--14e-═2CO32-+12H2O,2H2O+O2+4e-═4OH-,有关此电池的推断正确的是( )| A. | 电解质溶液中电子向正极移动 | |
| B. | 放电一段时间后,KOH的物质的量浓度不变 | |
| C. | 通乙烷的电极为负极 | |
| D. | 参加反应的O2和C2H6的物质的量之比为2:7 |
分析 A.电子不经过电解质溶液;
B.根据电池总反应C2H6+4OH-+$\frac{7}{2}$O2=2CO32-+5H2O判断;
C.燃料电池中燃料在负极反应;
D.根据得失电子相等确定氧化剂和燃料的物质的量之比.
解答 解:A.放电时,电解质溶液中阳离子向正极移动、阴离子向负极移动,电子不经过电解质溶液,故A错误;
B.电池反应式为C2H6+4OH-+$\frac{7}{2}$O2=2CO32-+5H2O,KOH的物质的量减少、溶液体积增大,所以KOH的物质的量浓度减小,故B错误;
C.燃料电池在,燃料失电子发生氧化反应、氧化剂得电子发生还原反应,所以通入乙烷的电极是负极,故C正确;
D.电池反应式为C2H6+4OH-+$\frac{7}{2}$O2=2CO32-+5H2O,则参加反应的氧气与C2H6的物质的量之比为7:2,故D错误;
故选C.
点评 本题考查了化学电源新型电池,根据得失电子确定正负极反应,再结合电极反应式、离子移动方向来分析解答,离子移动方向的判断为易错点.

练习册系列答案
 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案
相关题目
14.如图所示,下列叙述正确的是( )


| A. | Y 与滤纸接触处有氧气生成 | B. | X 为正极,发生氧化反应 | ||
| C. | Y 为阴极,发生还原反应 | D. | X 与滤纸接触处变红 |
15.以熔融Li2CO3和K2CO3为电解质,天然气经重整催化作用提供反应气的燃料电池如右图.下列说法正确的是( )


| A. | 以此电池为电源电解精炼铜,当有0.1 mol e-转移时,有3.2 g铜溶解 | |
| B. | 若以甲烷为燃料气时负极电极反应式:CH4+5O2--8e-═CO32-+2H2O | |
| C. | 该电池使用过程中需补充Li2CO3和K2CO3 | |
| D. | 空气极发生的电极反应式为O2+4e-+2CO2═2CO32- |
12.下面对氯气的叙述正确的是( )
| A. | 氯气可使湿的红布条褪色,所以氯气具有漂白性 | |
| B. | 氯气没有漂白性,但通入品红溶液中,品红褪色 | |
| C. | 氯气不跟非金属反应 | |
| D. | 氯气有毒,闻其气味时要小心将集气瓶放在鼻孔下直接闻其气味 |
19.下列有关叙述正确的是( )
| A. | 电解饱和食盐水时,阴极的电极反应式为 2Cl--2e-═Cl2↑ | |
| B. | 放电时,铅蓄电池中硫酸浓度不断减小 | |
| C. | 氢氧燃料电池中,当电路上有1mol 电子通过时,则正极上消耗氧气为5.6L | |
| D. | 以锌片、铜片、稀硫酸组成原电池,当溶液中通过0.2mol电子时,负极减轻6.5g |
13.以酸性氢氧燃料电池为电源进行电解的实验装置如图所示.下列说法正确的是( )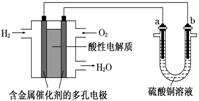

| A. | a极是铜,b极是铁时,a极逐渐溶解,b极上有铜析出 | |
| B. | 燃料电池工作时,正极反应为:O2+2H2O+4e-═4OH- | |
| C. | a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出 | |
| D. | a、b两极若是石墨,在相同条件下a极产生的气体与电池中消耗的H2体积相等 |
14.下列热化学方程式中,正确的是( )
| A. | 甲烷的燃烧热△H=-890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ/mol | |
| B. | 一定条件下,将0.5 mol N2和1.5 molH2置于密闭容器中充分反应生成NH3放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ/mol | |
| C. | 在101kPa时,2gH2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ/mol | |
| D. | HCl和NaOH反应的中和热△H=-57.3 kJ/mol,则H2SO4和Ba(OH)2反应的中和热△H=2×(-57.3)kJ/mol |