题目内容
铈是重要的稀土金属,可以从电视显示屏厂的废玻璃中提取,其工艺流程如下:请回答下列问题:
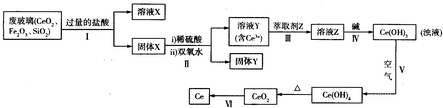
(1)溶液X中金属阳离子是 (用离子符号表示).固体Y的用途是
(写一条).
(2)用离子方程式表示步骤Ⅱ中双氧水的作用: .
(3)常温下,已知的溶度积=a,步骤Ⅳ调节溶液pH=8,c(Ce3+)=b mol?L-1.则a和b的关系是 .
(4)步骤Ⅲ中萃取剂Z具备的条件是 .
①Z不溶于水,也不和水反应
②Ce3+不和萃取剂Z发生反应
③Ce3+在萃取剂Z中溶解度于水
④萃取剂Z的密度一定大于水
(5)写出步骤V的化学方程式: .

(1)溶液X中金属阳离子是
(2)用离子方程式表示步骤Ⅱ中双氧水的作用:
(3)常温下,已知的溶度积=a,步骤Ⅳ调节溶液pH=8,c(Ce3+)=b mol?L-1.则a和b的关系是
(4)步骤Ⅲ中萃取剂Z具备的条件是
①Z不溶于水,也不和水反应
②Ce3+不和萃取剂Z发生反应
③Ce3+在萃取剂Z中溶解度于水
④萃取剂Z的密度一定大于水
(5)写出步骤V的化学方程式:
考点:物质分离和提纯的方法和基本操作综合应用,制备实验方案的设计
专题:实验设计题
分析:根据废玻璃粉末的成分(含SiO2、Fe2O3、CeO2等物质),SiO2、CeO2不能与盐酸反应,Fe2O3和盐酸反应得到溶液X即氯化铁溶液,得到的固体X是SiO2、CeO2等物质,CeO2与H2O2和稀H2SO4反应生成Ce3+,Ce元素由+4价变为+3价,被还原,则H2O2应被氧化生成O2,然后配平得出第③步反应的化学方程式 2CeO2+H2O2+3H2SO4═2Ce2(SO4)3+O2↑+4H2O;固体Y是二氧化硅,向含有Ce2(SO4)3的溶液中加入萃取剂,可以使Ce3+溶解在萃取剂中,向其中加入碱液,可以得到Ce(OH)3,然后被氧气氧化,可以得到Ce(OH)4,进行热分解可以得到CeO2,进一步获取金属单质Ce,
(1)SiO2、CeO2不能与氢盐酸反应,Fe2O3和盐酸反应得到溶液X即氯化铁溶液,根据二氧化硅的应用来回答;
(2)双氧水具有氧化性,CeO2与H2O2和稀H2SO4反应生成Ce3+,据此回答;
(3)根据Ce(OH)3的Ksp=c(Ce3+)?c3(OH-)来计算;
(4)根据萃取剂的选择要求来回答;
(5)Ce(OH)3可以被氧气氧化,可以得到Ce(OH)4,据此回答.
(1)SiO2、CeO2不能与氢盐酸反应,Fe2O3和盐酸反应得到溶液X即氯化铁溶液,根据二氧化硅的应用来回答;
(2)双氧水具有氧化性,CeO2与H2O2和稀H2SO4反应生成Ce3+,据此回答;
(3)根据Ce(OH)3的Ksp=c(Ce3+)?c3(OH-)来计算;
(4)根据萃取剂的选择要求来回答;
(5)Ce(OH)3可以被氧气氧化,可以得到Ce(OH)4,据此回答.
解答:
解:根据废玻璃粉末的成分(含SiO2、Fe2O3、CeO2等物质),SiO2、CeO2不能与盐酸反应,Fe2O3和盐酸反应得到溶液X即氯化铁溶液,得到的固体X是SiO2、CeO2等物质,CeO2与H2O2和稀H2SO4反应生成Ce3+,Ce元素由+4价变为+3价,被还原,则H2O2应被氧化生成O2,然后配平得出第③步反应的化学方程式 2CeO2+H2O2+3H2SO4═2Ce2(SO4)3+O2↑+4H2O;固体Y是二氧化硅,向含有Ce2(SO4)3的溶液中加入萃取剂,可以使Ce3+溶解在萃取剂中,向其中加入碱液,可以得到Ce(OH)3,然后被氧气氧化,可以得到Ce(OH)4,进行热分解可以得到CeO2,进一步获取金属单质Ce,
(1)SiO2、CeO2不能与氢盐酸反应,Fe2O3和盐酸反应得到溶液X即氯化铁溶液,溶液X中金属阳离子是Fe3+,固体Y是二氧化硅,作光导纤维的原料、冶炼粗硅、耐高温材料等,故答案为:Fe3+;作光导纤维的原料、冶炼粗硅、耐高温材料等;
(2)CeO2与H2O2和稀H2SO4反应生成Ce3+,Ce元素由+4价变为+3价,被还原,则H2O2应被氧化生成O2,然后配平得出反应的化学方程式 2CeO2+H2O2+3H2SO4═2Ce2(SO4)3+O2↑+4H2O;离子反应为2CeO2+H2O2+6H+═2Ce3++O2↑+4H2O;
故答案为:2CeO2+H2O2+6H+═2Ce3++O2↑+4H2O;
(3)Ce(OH)3的Ksp=c(Ce3+)?c3(OH-),解得c(OH-)=
=
,pH=8,所以
=10-6,即a=10-18b,故答案为:a=10-18b;
(4)向含有Ce2(SO4)3的溶液中加入萃取剂,可以使Ce3+溶解在萃取剂中,则需要①Z不溶于水,也不和水反应②Ce3+不和萃取剂Z发生反应③Ce3+在萃取剂Z中溶解度大于水,故答案为:①②③;
(5)得到Ce(OH)3,然后被氧气氧化,可以得到Ce(OH)4,即4Ce(OH)3+O2+2H2O=4Ce(OH)4,故答案为:4Ce(OH)3+O2+2H2O=4Ce(OH)4.
(1)SiO2、CeO2不能与氢盐酸反应,Fe2O3和盐酸反应得到溶液X即氯化铁溶液,溶液X中金属阳离子是Fe3+,固体Y是二氧化硅,作光导纤维的原料、冶炼粗硅、耐高温材料等,故答案为:Fe3+;作光导纤维的原料、冶炼粗硅、耐高温材料等;
(2)CeO2与H2O2和稀H2SO4反应生成Ce3+,Ce元素由+4价变为+3价,被还原,则H2O2应被氧化生成O2,然后配平得出反应的化学方程式 2CeO2+H2O2+3H2SO4═2Ce2(SO4)3+O2↑+4H2O;离子反应为2CeO2+H2O2+6H+═2Ce3++O2↑+4H2O;
故答案为:2CeO2+H2O2+6H+═2Ce3++O2↑+4H2O;
(3)Ce(OH)3的Ksp=c(Ce3+)?c3(OH-),解得c(OH-)=
| 3 |
| ||
| 3 |
| ||
| 3 |
| ||
(4)向含有Ce2(SO4)3的溶液中加入萃取剂,可以使Ce3+溶解在萃取剂中,则需要①Z不溶于水,也不和水反应②Ce3+不和萃取剂Z发生反应③Ce3+在萃取剂Z中溶解度大于水,故答案为:①②③;
(5)得到Ce(OH)3,然后被氧气氧化,可以得到Ce(OH)4,即4Ce(OH)3+O2+2H2O=4Ce(OH)4,故答案为:4Ce(OH)3+O2+2H2O=4Ce(OH)4.
点评:本题以工艺流程为基础,考察化学实验基本操作、元素及化合物知识、化学计算、氧化还原反应等相关知识,难度大.

练习册系列答案
相关题目
在温度压强不变的情况下,已知N2O4?2NO2,2mol N2O4在密闭容器内分解成NO2,到达平衡时生成了0.6mol NO2,则平衡时气体的总物质的量是( )
| A、0.6mol |
| B、1.8mol |
| C、2.2mol |
| D、2.3mol |
镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用.已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd+2NiOOH+2H2O
Cd(OH)2+2Ni(OH)2有关该电池的说法正确的是( )
| 放电 |
| 充电 |
| A、充电时阳极反应:Ni(OH)2-e-+OH-=NiOOH+H2O |
| B、放电时负极附近溶液的pH不变 |
| C、放电时电解质溶液中的OH-向正极移动 |
| D、充电时Cd与外电源的正极相连 |




 某同学对实验室用石灰石和稀盐酸制取二氧化碳后的溶液进行成分鉴定,取废液的上层清液,开始出现气泡,滴加至10g才开始出现白色沉淀,继续滴加至沉淀不再产生,过滤,测的沉淀的质量为5g,并绘制出下列图象.
某同学对实验室用石灰石和稀盐酸制取二氧化碳后的溶液进行成分鉴定,取废液的上层清液,开始出现气泡,滴加至10g才开始出现白色沉淀,继续滴加至沉淀不再产生,过滤,测的沉淀的质量为5g,并绘制出下列图象.