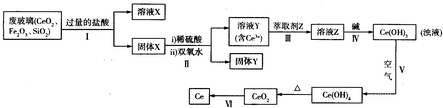
题目内容
 某同学对实验室用石灰石和稀盐酸制取二氧化碳后的溶液进行成分鉴定,取废液的上层清液,开始出现气泡,滴加至10g才开始出现白色沉淀,继续滴加至沉淀不再产生,过滤,测的沉淀的质量为5g,并绘制出下列图象.
某同学对实验室用石灰石和稀盐酸制取二氧化碳后的溶液进行成分鉴定,取废液的上层清液,开始出现气泡,滴加至10g才开始出现白色沉淀,继续滴加至沉淀不再产生,过滤,测的沉淀的质量为5g,并绘制出下列图象.(1)滴加的碳酸钠溶液中溶质属于
(2)已知质量分数为26.5%的碳酸钠溶液密度为1.25g?mL-1,则其溶质物质的量浓度为
(3)标准状况下,图象中的a点表示产生气体的体积是
(4)碳酸钠溶液从0g滴加至10g过程中,反应的离子方程式为
(5)通过计算,图象横坐标中b点时消耗的碳酸钠溶液的体积为
考点:离子方程式的有关计算,电解质与非电解质
专题:
分析:(1)在水溶液中或者熔融状态下能够导电的化合物为电解质;
(2)依据C、ρ、M的关系计算碳酸钠的物质的量浓度;
(3)(4)依据图象可知:0-10g时生成气体,说明溶液中含有盐酸,石灰石和稀盐酸制取二氧化碳后的溶液中含有盐酸和氯化钙,0-10g时生成气体,发生反应为:Na2CO3+2HCl=2NaCl+H2O+CO2↑;10-bg发生反应:碳酸钠与氯化钙反应生成碳酸钙沉淀,据此解答;
(5)依据Na2CO3+CaCl2=CaCO3↓+2NaCl计算产生5g沉淀消耗的碳酸钠溶液的质量然后求b,依据V=
计算需要碳酸钠溶液的体积.
(2)依据C、ρ、M的关系计算碳酸钠的物质的量浓度;
(3)(4)依据图象可知:0-10g时生成气体,说明溶液中含有盐酸,石灰石和稀盐酸制取二氧化碳后的溶液中含有盐酸和氯化钙,0-10g时生成气体,发生反应为:Na2CO3+2HCl=2NaCl+H2O+CO2↑;10-bg发生反应:碳酸钠与氯化钙反应生成碳酸钙沉淀,据此解答;
(5)依据Na2CO3+CaCl2=CaCO3↓+2NaCl计算产生5g沉淀消耗的碳酸钠溶液的质量然后求b,依据V=
| m |
| ρ |
解答:
解:(1)碳酸钠在水溶液中能够电离出钠离子和碳酸根离子而导电,属于电解质,故答案为:电解质;
(2)碳酸钠的物质的量浓度C=
=3.2mol/L,故答案为:3.2mol/L;
(3)10g溶液中含有碳酸钠的物质的量为:(10g×26.5%)÷106g/mol=0.025mol,发生反应为:Na2CO3+2HCl=2NaCl+H2O+CO2↑,所以:
Na2CO3+2HCl=2NaCl+H2O+CO2↑
1mol 22.4L
0.025mol V
=
,解得V=0.56L,
故答案为:0.56;
(4)0g滴加至10g过程中,发生反应为:Na2CO3+2HCl=2NaCl+H2O+CO2↑,离子方程式为:CO32-+2H+=H2O+CO2↑;10-bg产生沉淀发生反应:Na2CO3+CaCl2=CaCO3↓+2NaCl,所以原溶液中含有HCl和CaCl2;
故答案为:CO32-+2H+=H2O+CO2↑;HCl、CaCl2;
(5)10~bg产生沉淀发生反应:Na2CO3+CaCl2=CaCO3↓+2NaCl,依据方程式可知:
Na2CO3+CaCl2=CaCO3↓+2NaCl
106g 100g
m 5g
=
解得:m=5.3g,
消耗碳酸钠溶液的质量=
=20g,所以b=10+20=30(g),
溶液的体积V=
=
=24mL,
故答案为:24.
(2)碳酸钠的物质的量浓度C=
| 1000×1.25g/ml×26.5% |
| 106g/mol |
(3)10g溶液中含有碳酸钠的物质的量为:(10g×26.5%)÷106g/mol=0.025mol,发生反应为:Na2CO3+2HCl=2NaCl+H2O+CO2↑,所以:
Na2CO3+2HCl=2NaCl+H2O+CO2↑
1mol 22.4L
0.025mol V
| 1mol |
| 0.025mol |
| 22.4L |
| V |
故答案为:0.56;
(4)0g滴加至10g过程中,发生反应为:Na2CO3+2HCl=2NaCl+H2O+CO2↑,离子方程式为:CO32-+2H+=H2O+CO2↑;10-bg产生沉淀发生反应:Na2CO3+CaCl2=CaCO3↓+2NaCl,所以原溶液中含有HCl和CaCl2;
故答案为:CO32-+2H+=H2O+CO2↑;HCl、CaCl2;
(5)10~bg产生沉淀发生反应:Na2CO3+CaCl2=CaCO3↓+2NaCl,依据方程式可知:
Na2CO3+CaCl2=CaCO3↓+2NaCl
106g 100g
m 5g
| 106g |
| m |
| 100g |
| 5g |
消耗碳酸钠溶液的质量=
| 5.3g |
| 26.5% |
溶液的体积V=
| m |
| ρ |
| 30g |
| 1.25g?mL-1 |
故答案为:24.
点评:本题考查了有关离子方程式的计算,解题关键在于准确分析每段发生的化学反应,正确写出反应的化学方程式,题目难度不大.

练习册系列答案
相关题目
铝、钠混合物投入足量的水中,充分反应后,得到澄清溶液,并收集到4.48L H2(标准状况),若钠的物质的量为0.1mol,则铝的物质的量为( )
| A、0.1 mol |
| B、0.2 mol |
| C、0.05 mol |
| D、0.025 mol |
海水是一个巨大的化学资源宝库,下列有关海水综合利用的说法,正确的是( )
| A、海水中含有镁元素,只需经过物理变化就可以得到镁单质 |
| B、海水蒸发制海盐的过程中只发生了化学变化 |
| C、从海水中可以得到NaCl,电解NaCl溶液可得到金属钠 |
| D、从海水中提取Br2、I2的过程中发生了氧化还原反应 |
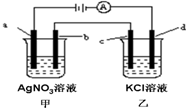 如图所示,a、b、c均为石墨电极,d为碳钢电极,通电进行电解.假设在电解过程中产生的气体全部逸出,下列说法正确的是( )
如图所示,a、b、c均为石墨电极,d为碳钢电极,通电进行电解.假设在电解过程中产生的气体全部逸出,下列说法正确的是( )| A、乙烧杯中的d电极反应式为Fe-2e-=Fe2+ |
| B、当电解一段时间后,将甲、乙两溶液混合,一定会沉淀 |
| C、当b极增重5.4g时,d极产生的气体为2.24L(标准状况) |
| D、甲烧杯中溶液的pH降低 |
下列物质与水反应,能放出氧气的是( )
| A、Na |
| B、Na2O |
| C、Na2O2 |
| D、NO2 |
若某基态原子的外围电子排布为4d15s2,则下列说法不正确的是( )
| A、该元素位于第五周期IB族 |
| B、该元素原子核外有5个电子层 |
| C、该元素原子最外层共有2个电子 |
| D、该元素原子M层上共有18个电子 |