题目内容
7. 已知A、B、C、D、E为元素周期表前四周期原子序数依次增大的元素,A原子核外有三个能级,每个能级上电子数相同,B原子的最外层p轨道的电子数为半充满结构,C、D为同主族元素,且D的原子序数是C的2倍,E2+的3d轨道上有10个电子.请回答下列问题:
已知A、B、C、D、E为元素周期表前四周期原子序数依次增大的元素,A原子核外有三个能级,每个能级上电子数相同,B原子的最外层p轨道的电子数为半充满结构,C、D为同主族元素,且D的原子序数是C的2倍,E2+的3d轨道上有10个电子.请回答下列问题:(1)元素D的基态原子价层电子排布式为1s22s22p63s23p4.
(2)A、B、C的最简单氢化物中,键角由大到小的顺序为CH4>NH3>H2O(用分子式表示),其中B的最简单氢化物的VSEPR模型名称为正四面体,C的最简单氢化物的分子立体构型名称为V型.
(3)AD2分子中,按原子轨道的重叠方式的不同存在的共价键类型有σ键、π键,其中A原子的杂化轨道类型为sp;写出两种与AD2互为等电子体的分子或离子CO2、N2O.
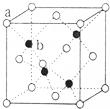
(4)ED在荧光体、光导体材料、涂料、颜料等行业中应用广泛.立方ED晶体结构如图所示,该晶体的密度为ρg•cm-3.如果ED的摩尔质量为Mg/mol,阿伏伽德罗常数为NAmol-1,则a、b之间的距离为$\frac{\sqrt{3}}{4}$$\root{3}{\frac{4M}{ρN{\;}_{A}}}$cm.
分析 A、B、C、D、E为元素周期表前四周期的元素,A原子核外有三个能级,每个能级上电子数相同,则A为C,C、D为同主族元素,且D的原子序数是C的2倍,则C为O,D为S,B原子的最外层p轨道的电子数为半充满结构,B的原子序数小于C,所以B为N,E2+的3d轨道上有10个电子,则E为Zn,据此答题.
解答 解:A、B、C、D、E为元素周期表前四周期的元素,A原子核外有三个能级,每个能级上电子数相同,则A为C,C、D为同主族元素,且D的原子序数是C的2倍,则C为O,D为S,B原子的最外层p轨道的电子数为半充满结构,B的原子序数小于C,所以B为N,E2+的3d轨道上有10个电子,则E为Zn,
(1)D为S,元素D的基态原子价层电子排布式为1s22s22p63s23p4 ,
故答案为:1s22s22p63s23p4;
(2)A、B、C的最简单氢化物分别为CH4、NH3、H2O,水分子中有两对孤电子对,氨分子中有一对孤电子对,甲烷中没有孤电子对,所以键角由大到小的顺序为CH4>NH3>H2O,其中NH3的VSEPR模型名称为正四面体,H2O的分子立体构型名称为V型,
故答案为:CH4>NH3>H2O;正四面体;V型;
(3)CS2分子结构式为S=C=S,按原子轨道的重叠方式的不同存在的共价键类型有σ键、π键,碳原子形成2个σ键,没有孤对电子,C原子的杂化轨道类型为sp,与CS2互为等电子体的分子或离子CO2、N2O、SCN-等,
故答案为:σ键、π键;sp;CO2、N2O;
(4)ZnS晶体结构如图所示,该晶胞中黑色球个数是4、白色球个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,该晶胞密度=$\frac{\frac{4M}{N{\;}_{A}}}{V}$=ρ g•cm-3,则V=$\frac{4M}{ρN{\;}_{A}}$cm3,ab之间距离为该晶胞体对角线长的$\frac{1}{4}$=$\sqrt{3}$×$\root{3}{\frac{4M}{ρN{\;}_{A}}}$ cm×$\frac{1}{4}$=$\frac{\sqrt{3}}{4}$$\root{3}{\frac{4M}{ρN{\;}_{A}}}$ cm,
故答案为:$\frac{\sqrt{3}}{4}$$\root{3}{\frac{4M}{ρN{\;}_{A}}}$.
点评 本题考查物质结构和性质,为高频考点,涉及晶胞计算、原子杂化方式判断、分子空间构型判断、原子核外电子排布等知识点,难点是晶胞计算中ab距离与晶胞体长关系,题目难度中等.

 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案| A. | 某芳香烃的分子式为C10H14,它不能使溴水褪色,但可使酸性KMnO4溶液褪色,且分子结构中只有一个烷基,符合条件的烃有3种 | |
| B. | 常压下,正戊烷、异戊烷、新戊烷的沸点依次降低 | |
| C. | 肌醇  与葡萄糖 与葡萄糖 的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,均属于糖类化合物 的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,均属于糖类化合物 | |
| D. | 1.0 mol的有机物(结构如图 )最多能与含5.0 mol NaOH的水溶液完全反应 )最多能与含5.0 mol NaOH的水溶液完全反应 |
| A. | 四氯化碳分子的比例模型: | |
| B. | 羟基可以表示为:-OH 或  | |
| C. | 氯离子(Cl-)的结构示意图: | |
| D. | NaHSO4熔融时的电离方程式:NaHSO4=Na++H++SO42- |
(1)
| 微粒符号 | 质子数 | 中子数 | 电子数 | 质量数 | |
| ① | ${\;}_{19}^{40}$K | 19 | 21 | 19 | 40 |
| ② | 3818Ar | 18 | 20 | 18 | 38 |
| ③ | 3216S2- | 16 | 16 | 18 | 32 |
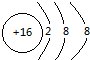 Mg2+
Mg2+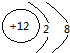 .
. | A | B | C |
| D |
| A. | C的非金属性最强,可分别与A、E元素形成离子化合物 | |
| B. | 元素D可形成三种常见的酸,且酸根离子均能促进水的电离 | |
| C. | C单质可以从D、E组成的化合物的水溶液中置换出D | |
| D. | 离子半径由大到小的顺序为:D>E>A>B>C |
 为解决淀粉厂沸水中BOD严重超标的问题,有人设计了电化学降解法,如图是利用一种微生物将废水中有机物[主要成分是(C6H10O5)n]的化学能转化为电能的装置,下列说法中正确的是( )
为解决淀粉厂沸水中BOD严重超标的问题,有人设计了电化学降解法,如图是利用一种微生物将废水中有机物[主要成分是(C6H10O5)n]的化学能转化为电能的装置,下列说法中正确的是( )| A. | N极是负极 | |
| B. | 负极的电极反应为(C6H10O5)n]+7nH2O-24ne-═6nCO2↑+24nH+ | |
| C. | 物质X是OH- | |
| D. | 该装置工作时,H+从右侧经阳离子交换膜转向左侧 |
 高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:CO(g)+2H2(g)?CH3OH(g).请根据图示回答下列问题.
高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:CO(g)+2H2(g)?CH3OH(g).请根据图示回答下列问题.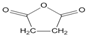 ),试剂③是环氧乙烷(
),试剂③是环氧乙烷(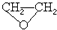 ),且环氧乙烷在酸或碱中易水解或聚合.
),且环氧乙烷在酸或碱中易水解或聚合.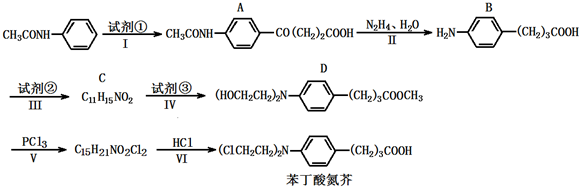
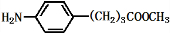
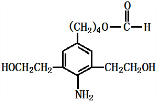
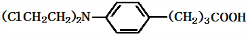 +3NaOH$\stackrel{△}{→}$
+3NaOH$\stackrel{△}{→}$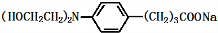 +2NaCl+H2O
+2NaCl+H2O